 |
 |
AbstractBackground and ObjectivesSj├ÂgrenÔÇÖs syndrome (SS) is an autoimmune inflammatory disorder of exocrine glands characterized by dry mouth and eye. Recently, ultrasonography has become a valuable tool for the assessment of salivary gland involvement in SS although studies on the usefulness of salivary gland CT is rare. In this regard, we evaluated the diagnostic accuracy of parotid gland CT for SS.
Subjects and MethodA total of 91 patients with sicca symptoms took a parotid CT, a serology test, an ophthalmologic examination and a minor salivary gland biopsy. At the end, as a standard, we diagnosed the primary SS according to the new 2016 American College of Rheumatology/European League Against Rheumatism classification criteria. The diagnostic value of parotid CT was compared by the McNemar test.
ResultsOf the total of 91 patients with parotid CT, 37 (40.7%) patients met the SS classification criteria. On the parotid CT, heterogeneity of the parotid gland has the sensitivity of 74.1%, specificity of 70.3%, and accuracy of 71.4%. The abnormal fat tissue deposition showed the sensitivity of 74.1%, specificity of 81.3%, and accuracy of 79.1%. Diffuse calcification was seen in 1/91 SS patients (sensitivity 3.7%, specificity 100%, accuracy 71.4%).
ìä£ Ùíáìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░(Sjo┬¿grenÔÇÖs syndrome, SS)ìØÇ ÿâÇìòíìäáÛ│╝ ÙêêÙ¼╝ìâİ Ùô▒ìØİ ìÖ©ÙÂäÙ╣äìâİìØİ ÙĞ╝ÿöäÛÁ¼ ì╣¿ì£ñìØä ÿè╣ìğòì£╝Ùí£ ÿòİÙèö ÙÑİÙğêÿï░ìèñìä▒ ìŞÉÛ░Ç Ù®┤ìù¡ ìğêÿÖİì£╝Ùí£ Û░üìä▒ Û▓░Ùğëìù╝Û│╝ Û▒┤ìí░ìĞØìØä ì£áÙ░£ÿòá Ù┐ÉÙğî ìòäÙïêÙØ╝ Û┤ÇìáêÿåÁ, Û┤Çìáêìù╝ Ùô▒ìØİ ìĞØìâüÛ│╝ ÿö╝ÙÂÇ, ÿÅÉ, ìïáìŞÑ ÿİ╣ìØÇ ìïáÛ▓¢Û│ä ìĞØìâü Ùô▒ìØİ ìâİìÖ© ìĞØìâü(extra-glandular manifestations)ìØä ìØ╝ì£╝ÿéñÛ©░ÙÅä ÿò£Ùïñ[1]. ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØİ ìğäÙï¿ì£╝Ùí£Ùèö 2002Ùàä Ù»©ÛÁ¡-ì£áÙş¢ ÿò®ìØİÛÀ©Ùú╣(American-European Consensus Group, AECG)ìùÉìä£ Ù░£ÿæ£ÿò£ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÙÂäÙÑİÛ©░ìñÇìØ┤ Û░ÇìŞÑ Ù│┤ÿÄ©ìáüì£╝Ùí£ ìé¼ìÜ®ÙÉİÙèöÙı░, ìù¼Û©░ìùö ÿâÇìòíìäáÛ│╝ ÙêêÙ¼╝ìâİìØİ ìú╝Û┤Çìáü, Û░ØÛ┤Çìáü ìĞØìâüÛ│╝ ìåîÿâÇìòíìäá ìí░ìğü Û▓Çìé¼ìØİ Ù│æÙмÿòÖìáü ìåîÛ▓¼, ÿò¡-SSA/Ro, ÿò¡-SSB/LaÙô▒ìØİ ÿò¡Ù¬®ìØ┤ ÿżÿò¿ÙÉ£Ùïñ[2]. ìØ┤ÿøä 2012Ùàä Ù»©ÛÁ¡ ÙÑİÙğêÿï░ìèñÿòÖÿÜî(American College of Rheumatology, ACR)ìùÉìä£ ìâêÙí£ìÜ┤ ÙÂäÙÑİÛ©░ìñÇìØä Ù░£ÿæ£ÿòİìİÇÙèöÙı░, ìù¼Û©░ìùö ìòêÛÁ¼ ìù╝ìâë ìáÉìêİ(ocular staining score)ìÖÇ ÙĞ╝ÿöäÛÁ¼ìä▒ ì╣¿ìâİìù╝(lymphocytic sialadenitis) ìØ┤ ÿżÿò¿ÙÉİìû┤ ìóÇ Ùıö Û░ØÛ┤ÇìáüìØ© Û©░ìñÇìØä Û░òÿÖöÿòİìİÇÙïñ[3]. 2016Ùàä ACR/European League Against Rheumatism(EULAR)ìùÉìä£ Ù░£ÿæ£ÿò£ ÙÂäÙÑİÛ©░ìñÇìØÇ ìïñìᣠìŞäìâüìùÉìä£ ìáüìÜ®ìØ┤ ìÜ®ìØ┤ÿòİÙÅäÙíØ ìë¢Û▓î ìï£ÿûëÿòá ìêİ ìŞêÛ│á, Û░ØÛ┤ÇìáüìØ© Û©░ìñÇÙôñÙí£ ÛÁ¼ìä▒ÙÉİìùêÙïñ[4].
ìğÇÛ©êÛ╣îìğÇ Ù░£ÿæ£ÙÉ£ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØİ ÙÂäÙÑİÛ©░ìñÇìùÉÙèö ìİüìâüìØİÿòÖìáü Û▓Çìé¼Û░Ç ìğäÙï¿Û©░ìñÇì£╝Ùí£ ÿżÿò¿ÙÉ£ ìáüìØ┤ ìùåìùêì£╝Ù®░, ìÁ£ÛÀ╝ ì┤êìØîÿîîÛ░Ç ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØİ ìğäÙï¿ìùÉ ÙÅäìøÇìØ┤ ÙÉ£ÙïñÙèö ìù░ÛÁ¼Û░Ç ìŞêìùêì£╝Ùéİ[5-7], ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØİ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ìğäÙï¿ìùÉìØİ ì£áìÜ®ìä▒ìùÉ ÙîÇÿò£ ìù░ÛÁ¼Ùèö Û▒░ìØİ ìùåìû┤ ÛÀ© ì£áìÜ®ìä▒ìØ┤ ìáòÙĞ¢ÙÉİìğÇ ìòèìòİÙïñ[8,9].
Ù│© ìù░ÛÁ¼ìùÉìä£Ùèö ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØ┤ ìØİìï¼ÙÉİÙèö ÿÖİìŞÉÙÑ╝ ÙîÇìâüì£╝Ùí£ ìØ┤ÙÑ╝ ìğäÙï¿ÿò¿ìùÉ ìŞêìû┤ ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØİ ìğäÙï¿ìáü ì£áìÜ®ìä▒ìùÉ ÙîÇÿò┤ ìáòÙ│┤ÙÑ╝ ìá£Û│ÁÿòİÛ│áìŞÉ ÿò£Ùïñ.
ÙîÇìâü Ù░Å Ù░®Ù▓òÙîÇ ìâüÙ│© ìù░ÛÁ¼Ùèö 2012Ùàä 1ìøö~2018Ùàä 12ìøöÛ╣îìğÇ ÙêêÙğêÙĞäìØ┤Ùéİ ìŞàÙğêÙĞäì£╝Ùí£ ìØ©ÿòİÙîÇÙ│æìøÉìØä Ùé┤ìøÉÿò£ ÿÖİìŞÉÙí£ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØ┤ ìØİìï¼ÙÉİÙèö ÿÖİìŞÉ ìñæ ÙïñÙÑ© ìØ┤ì£á(Û▓¢ÙÂÇìùÉ Ùğîìá©ìğÇÙèö Ùı®ìØ┤Ùéİ Û▓¢ÙÂÇ ÙĞ╝ÿöäìáê ìóàÙîÇ, ÙÂÇÙ╣äÙÅÖìù╝, Û░æìâüìäá ìğêÿÖİ Ùô▒)Ùí£ ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØä ìï£ÿûëÿò£ ÿÖİìŞÉÙôñìØä ÙîÇìâüì£╝Ùí£ ÿòİìİÇÙïñ. ÙæÉÛ▓¢ÙÂÇìùÉ Ù░®ìé¼ìäá ìí░ìé¼ÙÑ╝ Ù░øìØÇ ìáüìØ┤ ìŞêÛ▒░Ùéİ, Ù░®ìé¼ìä▒ ìÜöìİñÙô£ ì╣İÙúîÙÑ╝ Ù░øìØÇ ìáüìØ┤ ìŞêÙèö ÿÖİìŞÉÙèö Ù░░ìá£ÙÉİìùêì£╝Ù®░, ìŞàÙğêÙĞäìØä ì£áÙ░£ÿòá ìêİ ìŞêÙèö ìò¢ìá£[10] (ÿò¡ìÜ░ìÜ©ìá£, ÿò¡ìáòìïáÙ│æìò¢, ÿò¡ì¢£ÙĞ░ìá£, ÿò¡Û│áÿİêìòòìá£, ÿò¡ÿŞêìèñÿâÇÙ»╝ìá£, ìğäìáòìᣠÙô▒)ÙÑ╝ Ù│ÁìÜ®ÿò£ ÿÖİìŞÉÙôñÙÅä ÙîÇìâüìùÉìä£ ìá£ìÖ©ÙÉİìùêÙïñ. ÙîÇìâü ÿÖİìŞÉìùÉìä£ ìâüìä©ÿò£ Ù¼©ìğäÛ│╝ ìäñÙ¼©ìØä ÿåÁÿò┤ Ù│æÙáÑìØä ì▓¡ìÀ¿ÿòİìİÇÛ│á, ìØ┤ÿòİìäá ìáäìé░ÿÖö Ùï¿ì©Áì┤¼ìİü, ÿİêì▓¡ÿòÖìáü Û▓Çìé¼, ìòêÛ│╝ÿòÖìáü Û▓Çìé¼ ÛÀ©ÙмÛ│á ìåîÿâÇìòíìäá ì╣¿ìâİ ìí░ìğü Û▓Çìé¼ÙÑ╝ ìï£ÿûëÿòİìİÇÙïñ. Ù│© ìù░ÛÁ¼Ùèö ìØİÙúîÛ©░ÙíØìØä Û▓Çÿåáÿòİìù¼ ÿøäÿûÑìáü ìù░ÛÁ¼Ùí£ ìğäÿûëÙÉİìùêì£╝Ù®░, ìØ©ÿòİÙîÇÿòÖÛÁÉÙ│æìøÉ Institutional Review Board(INHUH 2019-03-020-002)ìØİ ìè╣ìØ©ìØä ìû╗ìùêÛ│á ìáêì░¿ÙÑ╝ ìñÇìêİÿòİìİÇÙïñ.
Ù░® Ù▓òìŞàÙğêÙĞä, ÙêêÙğêÙĞäìØİ ìú╝Û┤Çìáü ìĞØìâüìØä ÿİ©ìåîÿòİÙèö ÙîÇìâü ÿÖİìŞÉÙôñìØÇ ÿİêì▓¡ÿòÖìáü Û▓Çìé¼[ÿò¡-Ro/SSA(62Ù¬à), ÿò¡-La/SSB(58Ù¬à), ÙÑİÙğêÿï░ìèñ ìØ©ìŞÉ(65Ù¬à), ÿò¡ÿòÁÿò¡ì▓┤(76Ù¬à)], ìàöÙ¿© Û▓Çìé¼(52Ù¬à), Ù╣äìŞÉÛÀ╣ ÿâÇìòíìåıÙÅä Û▓Çìé¼(32Ù¬à), ìåîÿâÇìòíìäá ìí░ìğü Û▓Çìé¼(11Ù¬à)ÙÑ╝ ìï£ÿûëÿòİìİÇÙïñ. Û▓Çìé¼ Û▓░Û│╝ÙÑ╝ ÿåáÙîÇÙí£ 2016Ùàä Ù░£ÿæ£ÙÉ£ ACR/EULAR ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÙÂäÙÑİ Û©░ìñÇ [4](Supplementary Table 1 in the online-only Data Supplement)ìùÉ Ùö░ÙØ╝ 4ìáÉ ìØ┤ìâüìØ© Û▓¢ìÜ░ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÀ©Ùú╣ì£╝Ùí£ ÙÂäÙÑİÿòİìİÇÛ│á, ìğäÙï¿Û©░ìñÇìùÉ ÙÂÇÿò®ÿòİìğÇ ìòèìØÇ ÛÁ░ìØÇ Û▒┤ìí░ ìĞØìâü (non-Sjo┬¿grenÔÇÖs sicca syndrome)ÛÁ░ì£╝Ùí£ ÛÁ¼ÙÂäÿòİìİÇÙïñ. ÙæÉ ÛÁ░ìùÉìä£ ÿİêì▓¡ÿòÖìáü Û▓Çìé¼(ÿò¡-Ro/SSA, ÿò¡-La/SSB, ÙÑİÙğêÿï░ìèñ ìØ©ìŞÉ, ÿòÖÿûëÿò¡ì▓┤), ìàöÙ¿© Û▓Çìé¼, Ù╣äìŞÉÛÀ╣ ÿâÇìòíìåıÙÅä Û▓Çìé¼, ìåîÿâÇìòíìäá ìí░ìğü Û▓Çìé¼ Ù░Å ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİü ìåîÛ▓¼ìØä Ù╣äÛÁÉÿòİìİÇÙïñ.
ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİü ìåîÛ▓¼ìØÇ ÙæÉÛ▓¢ÙÂÇ ìİüìâü ÿîÉÙÅàìØİ 20ìù¼ ÙàäìØİ Û▓¢ÙáÑìØ┤ ìŞêÙèö 1Ù¬àìØİ ìİüìâüìØİÿòÖÛ│╝ ìáäÙ¼©ìØİÛ░Ç ÙÅàÙĞ¢ìáüì£╝Ùí£ ÿîÉÙÅàÿòİìİÇì£╝Ù®░, 1) ìØ┤ÿòİìäáìØİ ÛÀáìğêìä▒ìØİ ì£áÙ¼┤, 2) Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░®, 3) Û┤æÙ▓öì£äÿò£ ìäØÿÜîÿÖö ìåîÛ▓¼(Fig. 1)ìØİ 3Û░ÇìğÇ ìé¼ÿò¡ìùÉ ÙîÇÿò┤ ÙÂäìäØÿòİìİÇÙïñ[9]. ÿåÁÛ│äìáü ÙÂäìäØìØÇ WindowsìÜ® SPSS ÿöäÙí£ÛÀ©ÙŞ¿(Version 22.0, SPSS Inc., Armonk, NY, USA)ìØä ìé¼ìÜ®ÿòİìù¼ t Û▓ÇìáòÛ│╝ ì╣┤ìØ┤ ìá£Û│▒ Û▓Çìáò Ù░®Ù▓òìØä ìé¼ìÜ®ÿòİìİÇì£╝Ù®░, ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØİ Ù»╝Û░ÉÙÅäìÖÇ ÿè╣ìØ┤ÙÅäìùÉ ÙîÇÿò£ ìğêìáü Û©░ìñÇìØİ ìğäÙï¿ ì£áìÜ®ìä▒ìØÇ McNemar testÙí£ ÿÅëÛ░ÇÿòİìİÇÙïñ.
Û▓░ Û│╝Ù│© ìù░ÛÁ¼ìùÉ ì░©ìù¼ÿò£ 91Ù¬àìØİ ÙîÇìâüìŞÉ ìñæ Ùé¿ìŞÉÙèö 15Ù¬à ìù¼ìŞÉÙèö 76Ù¬àìØ┤ìùêì£╝Ù®░, ÿÅëÛÀáìù░Ùá╣ìØÇ 59.08┬▒12.80ìä©ìİÇÙïñ. ì┤Ø 91Ù¬àìØİ ÙîÇìâüìŞÉ ìñæ 2016Ùàä ACR/EULARìØİ ÙÂäÙÑİÛ©░ìñÇìùÉ ÿò┤Ùï╣ÿòİìù¼ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ì£╝Ùí£ ÙÂäÙÑİÙÉİÙèö ÿÖİìŞÉÙèö 27Ù¬àìØ┤ìùêÛ│á ìğäÙï¿Û©░ìñÇìùÉ ÙÂÇÿò®ÿòİìğÇ ìòèìØÇ ÛÁ░ìØÇ 64Ù¬àì£╝Ùí£ Û▒┤ìí░ ìĞØìâüÛÁ░(non-Sjo┬¿grenÔÇÖs sicca syndrome)ì£╝Ùí£ ÛÁ¼ÙÂäÿòİìİÇÙïñ. ÙæÉ ÛÀ©Ùú╣ìØä Ù╣äÛÁÉÿûêìØä Ùòî, Ù╣äìŞÉÛÀ╣ ÿâÇìòíìåıÙÅä Û▓Çìé¼Ùèö Û▒┤ìí░ ìĞØìâüÛÁ░ìùÉìä£ 0.26 mL/min, ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÀ©Ùú╣ìùÉìä£ 0.14 mL/minì£╝Ùí£ ÙéİÿâÇÙé¼ì£╝Ù®░(p=0.026) ìåîÿâÇìòíìäá ìí░ìğü Û▓Çìé¼ìâü focus scoreÛ░Ç 1ìáÉ ìØ┤ìâüìØ© ÙĞ╝ÿöäÛÁ¼ìä▒ ì╣¿ìâİìù╝(focal lymphocytic sialadenitis)ìØä Ù│┤ìØ© ÙîÇìâüìŞÉÙèö Û▒┤ìí░ ìĞØìâüÛÁ░ìùÉìä£ 6Ù¬à ìñæ 1Ù¬à(16.7%), ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÀ©Ùú╣ìùÉìä£ 5Ù¬à ìñæ 5Ù¬à(100%)ì£╝Ùí£ ÙéİÿâÇÙé¼Ùïñ(p=0.013). ÿİêì▓¡ÿòÖìáü Û▓Çìé¼ìâü ÿò¡-Ro/SSA Û▓Çìé¼ìùÉìä£ Û▒┤ìí░ ìĞØìâüÛÁ░ìØÇ 25.7%, ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÀ©Ùú╣ìØÇ 88.9%ìùÉìä£ ìûæìä▒ìØä Ù│┤ìİÇì£╝Ù®░(p<0.001), ÿò¡-La/SSA Û▓Çìé¼ìùÉìä£ Û▒┤ìí░ ìĞØìâüÛÁ░ìØÇ 12.9%, ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÀ©Ùú╣ìØÇ 51.9%ìùÉìä£ ìûæìä▒(p=0.002) ìåîÛ▓¼, ÿò¡ÿòÁÿò¡ì▓┤ Û▓Çìé¼ìùÉìä£ Û▒┤ìí░ ìĞØìâüÛÁ░ìØÇ 14.3%, ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ÛÁ░ìØÇ 48.1%ìùÉìä£ ìûæìä▒(p=0.002), ÙÑİÙğêÿï░ìèñìØ©ìŞÉ Û▓Çìé¼ìùÉìä£ Û▒┤ìí░ ìĞØìâüÛÁ░ìØÇ 15.4%, ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÀ©Ùú╣ìØÇ 57.7%ìùÉìä£ ìûæìä▒(p=0.001) ìåîÛ▓¼ìØä Ù│┤ìİÇÙïñ. ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Á ì┤¼ìİüìØİ ìåîÛ▓¼ìâü ÙæÉ ÛÀ©Ùú╣ìùÉìä£ ìØ┤ÿòİìäáìØİ ÛÀáìğêìä▒ìØä ÙÂäìäØÿòİìİÇìØä Ùòî Ù╣äÛÀáìğêìä▒ìØä Ù│┤ìØ© ÿÖİìŞÉìêİÛ░Ç Û▒┤ìí░ ìĞØìâüÛÁ░ìùÉìä£Ùèö 19Ù¬à(29.7%), ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÀ©Ùú╣ìùÉìä£Ùèö 20Ù¬à(74.1%)ì£╝Ùí£ ÙéİÿâÇÙé¼ì£╝Ù®░(p<0.001), Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░® ìåîÛ▓¼ìØä Ù│┤ìØ© ÿÖİìŞÉÙèö Û▒┤ìí░ ìĞØìâüÛÁ░ìùÉìä£ 12Ù¬à(18.8%), ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÀ©Ùú╣ìùÉìä£ 20Ù¬à(74.1%)(p<0.001), Û┤æÙ▓öì£äÿò£ ìäØÿÜîÿÖö ìåîÛ▓¼ìØä Ù│┤ìØ© ÿÖİìŞÉÙèö Û▒┤ìí░ ìĞØìâüÛÁ░ìùÉìä£Ùèö ìùåìùêì£╝Ù®░, ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÀ©Ùú╣ìùÉìä£Ùèö 1Ù¬à(3.7%)(p=0.297)ì£╝Ùí£ ÙéİÿâÇÙé¼Ùïñ(Table 1).
ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ìğäÙï¿ìùÉìä£ìØİ ìØ┤ÿòİìäá ìáäìé░ÿÖö Ùï¿ì©Áì┤¼ìİüìØİ Ù»╝Û░ÉÙÅä, ÿè╣ìØ┤ÙÅä, ìáòÿÖòÙÅäìùÉ ÙîÇÿò£ ÙÂäìäØìùÉìä£Ùèö ìØ┤ÿòİìäáìØİ ÛÀáìğêìä▒ìØä Û©░ìñÇì£╝Ùí£ ÿòİìİÇìØä Ùòî, Ù»╝Û░ÉÙÅä 74.1%, ÿè╣ìØ┤ÙÅä 70.3%, ìáòÿÖòÙÅä 71.4%(p<0.001), Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░® ìåîÛ▓¼ìØä Û©░ìñÇì£╝Ùí£ ÿòİìİÇìØä Ùòî Ù»╝Û░ÉÙÅä 74.1%, ÿè╣ìØ┤ÙÅä 81.3%, ìáòÿÖòÙÅä 79.1%(p<0.001)ìİÇÙïñ. Û┤æÙ▓öì£äÿò£ ìäØÿÜîÿÖö ìåîÛ▓¼ìØä Ù│┤ìØ© ÿÖİìŞÉÙèö ìáäì▓┤ 91Ù¬àìØİ ÿÖİìŞÉ ìñæ 1Ù¬àì£╝Ùí£ Ù»╝Û░ÉÙÅä 3.7%, ÿè╣ìØ┤ÙÅä 100%, ìáòÿÖòÙÅä 71.4% (p´╝Ş0.05)ÙÑ╝ Ù│┤ìİÇÙïñ(Table 2).
ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØİ Û▓░Û│╝ìÖÇ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ìğäÙï¿Û©░ìñÇìØİ Û░ü ÿò¡Ù¬®Û│╝ìØİ ìù░Û┤Çìä▒ìùÉ ÙîÇÿò£ ÙÂäìäØìùÉìä£Ùèö Û▒┤ìí░ ìĞØìâüÛ│╝ Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░® ìåîÛ▓¼ìØ┤ ì£áìØİÿò£ ìâüÛ┤ÇÛ┤ÇÛ│äÙÑ╝ Ù│┤ìİÇÛ│á(p<0.05), Ù╣äÛÀáìğêìä▒Û│╝ Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░® ìåîÛ▓¼ Ù¬¿ÙæÉ ÿò¡-Ro/SSA, ÿò¡-La/SSAìÖÇ ì£áìØİÿò£ ìâüÛ┤ÇÛ┤ÇÛ│äÙÑ╝ Ù│┤ìİÇÙïñ (p<0.05).
Receiver operating characteristic curve Û│íìäá(ROC)ìØä ÿåÁÿò┤ Û│äìé░ÿò£ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ìğäÙï¿ìùÉìä£ìØİ ìØ┤ÿòİìäá ìáäìé░ÿÖö Ùï¿ì©Áì┤¼ìİüìØİ ìğäÙï¿ìáü Û░Çì╣İìùÉ ÙîÇÿò£ ÙÂäìäØìùÉìä£Ùèö ìØ┤ÿòİìäáìØİ ÛÀáìğêìä▒ìØä Û©░ìñÇì£╝Ùí£ ÿòİìİÇìØä Ùòî area under the curve(AUC)Ùèö 0.722(p=0.001), Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░®ìåîÛ▓¼ìØä Û©░ìñÇì£╝Ùí£ ÿòİìİÇìØä Ùòî AUCÙèö 0.777(p<0.001), Û┤æÙ▓öì£äÿò£ ìäØÿÜîÿÖöÙÑ╝ Û©░ìñÇì£╝Ùí£ ÿòİìİÇìØä ÙòîìØİ AUCÙèö 0.519(p=0.781)Ùí£ Û│äìé░ÙÉİìùêÙïñ(Fig. 2).
Û│á ì░░ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØİ ÙÂäÙÑİÛ©░ìñÇì£╝Ùí£ Û░ÇìŞÑ ÙäÉÙм ìô░ìØ© Û▓âìØÇ 2002Ùàä AECG ÙÂäÙÑİÛ©░ìñÇìØ┤Ù®░[1], ìØ┤ ÙÂäÙÑİÛ©░ìñÇìùÉÙèö ìú╝Û┤Çìáü Û▒┤ìí░ ìĞØìâüìùÉ ÙîÇÿò£ ìäñÙ¼©Û│╝ ÿò¿Û╗İ ìàöÙ¿© Û▓Çìé¼(Schirmer test), Ù╣äìŞÉÛÀ╣ ÿâÇìòí ìåıÙÅä Û▓Çìé¼(unstimulated whole saliva flow rate), ìØ┤ÿòİìäá ÿâÇìòíìäá ìí░ìİüìêá(parotid sialography), ÿâÇìòíìäá ìïáÿï░ÛÀ©ÙŞİÿö╝ (salivary scintigraphy), ìåîÿâÇìòíìäá ìí░ìğü Û▓Çìé¼ Ùô▒ìØ┤ ÿżÿò¿ÙÉİìùêÙïñ. ìİüìâüÿòÖìáü Û▓Çìé¼ìØ© ÿâÇìòíìäá ìí░ìİüìêáìØÇ Û▓Çìé¼ìŞÉìØİ Û▓¢ÿùİìØ┤ ìñæìÜöÿòİÛ│á, Û▓Çìé¼ìØİ Ù│ÁìŞíìä▒ ÙòîÙ¼©ìùÉ ìŞÉìú╝ ìô░ìØ┤ìğÇ ìòèÙèö Û▓Çìé¼ìØ┤Ù®░, ìïáÿï░ÛÀ©ÙŞİÿö╝Ùèö ÙïñÙÑ© ÿàîìèñÿè©ìùÉ Ù╣äÿò┤ ÿè╣ìØ┤ÙÅäÛ░Ç Ùé«ÙïñÙèö ìáÉÛ│╝ Ù░®ìé¼ìäá Ùà©ì£ìØİ Ùï¿ìáÉìØä Û░ÇìğÇÛ│á ìŞêÙïñ[11,12]. ìÁ£ÛÀ╝ ìç╝ÛÀ©Ùáî ìğäÙï¿ìùÉ ì┤êìØîÿîî Û▓Çìé¼Û░Ç ìŞäìâüìáüì£╝Ùí£ ìØ┤ìÜ®ÙÉİÛ│á ìŞêÛ│á, ì┤êìØîÿîîìØİ ì£áìÜ®ìä▒ìùÉ ÙîÇÿò£ ìù░ÛÁ¼Û░Ç ÿÖ£Ù░£ÿŞê ìØ┤Ùú¿ìû┤ìğÇÛ│á ìŞêì£╝Ù®░ [5,6] ì┤êìØîÿîî ìåîÛ▓¼ìØ┤ ìåîÿâÇìòíìäá ìí░ìğü Û▓Çìé¼ìØİ ìí░ìğüÿòÖìáü ìåîÛ▓¼, ì╣¿ìâİ Û©░ÙèÑ, ÿò¡-SSA/Ro ÿò¡ì▓┤ìÖÇìØİ ìù░Û┤Çìä▒ìØ┤ ìŞêÙïñÛ│á Ù│┤Û│áÙÉİìùêÙïñ[7]. ÿòİìğÇÙğî ì╣¿ìâİ ì┤êìØîÿîî ìù¡ìï£ Û▓Çìé¼ìŞÉ Û░äìØİ ÿò┤ìäØìØ┤ Ùïñìûæÿòá ìêİ ìŞêÙïñÙèö Ùï¿ìáÉìØ┤ ìŞêÙïñ. ÿò£ÿÄ©, ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÿÖİìŞÉÙôñìØÇ ìŞÉÛ©░Û│ÁÙ¬àìİüìâü Û▓Çìé¼ìùÉìä£ ìğÇÙ░® ìí░ìğüÙôñìØÇ ÛÀáìØ╝ÿòİÛ▓î ÙÂäÿżÿòİÛ│á, Ùé«ìØÇ Û░ÉìçáÙÑ╝ Ù│┤ìØ┤Ùèö ÿè╣ìğòìØ┤ ìŞêì£╝Ù®░, ìØ┤ÿòİìäá ìïñìğêìùÉ ÿîîÛ┤┤Û░Ç ìâØÛ©© Û▓¢ìÜ░ ìğÇÙ░® ìí░ìğüÙôñìØ┤ Ù│ÇÿòİÛ│á ÙÂêÛÀáìğêÿò£ ìğÇÙ░® ìí░ìğüìØİ ì╣¿ì░®ìØä Ù│┤ìØ©Ùïñ[8,13,14]. ìŞÉÛ©░Û│ÁÙ¬àìİüìâü Û▓Çìé¼Ùèö ìòêìáäÿòİÛ│á ìğüìáæìáüì£╝Ùí£ ìú╝ì╣¿ìâİìØä ìï£Û░üÿÖöÿòİìù¼ Ù│╝ ìêİ ìŞêÙèö ìŞÑìáÉìØ┤ ìŞêìğÇÙğî, Û░ÇÛ▓®ìØ┤ Ù╣äìï©Û│á Û▓Çìé¼ ìï£Û░äìØ┤ ìİñÙŞİ Û▒©ÙмÙèö Ùï¿ìáÉìØ┤ ìŞêÙïñ.
Ù│© ìù░ÛÁ¼ìùÉìä£Ùèö 2016Ùàä ACR/EULAR ÙÂäÙÑİÛ©░ìñÇìùÉ Ùö░ÙØ╝ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØİ ìğäÙï¿Û©░ìñÇìØä Ùğîìí▒ìï£ÿéñÙèö ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÀ©Ùú╣Û│╝ ÛÀ©ÙáçìğÇ ìòèìØÇ Û▒┤ìí░ ìĞØìâüÛÁ░ìØİ ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©ÁÿÖ£ìİü ìåîÛ▓¼ìØä Ù╣äÛÁÉÿò£ Û▓░Û│╝, ìØ┤ÿòİìäáìØİ Ù╣äÛÀáìğêìä▒Û│╝ Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░® ìåîÛ▓¼ìØÇ ÙæÉ ÛÁ░ Û░äìùÉ ÿåÁÛ│äìáüì£╝Ùí£ ì£áìØİÿò£ ì░¿ìØ┤Û░Ç ìŞêìØîìØä ÿÖòìØ©ÿòá ìêİ ìŞêìùêÙïñ. ìØ┤Ùèö ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØ┤ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØä ìğäÙï¿ÿòİÙèö Ùı░ ÙÅäìøÇìØä ìñä ìêİ ìŞêìØîìØä ìï£ìé¼ÿò£Ùïñ. BaerìÖÇ Walitt [15]Ùô▒ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÿÖİìŞÉìØİ Û▓¢ìÜ░ ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìùÉìä£ ìØ┤ÿòİìäáìØÇ ÙïñÙ░£ìä▒ ìäØÿÜîÿÖö ìåîÛ▓¼ìØä Ù│┤ìØ┤Ù®░, ìŞÉÛ©░Û│ÁÙ¬àìİüìâüìâü T1, T2 Û░òìí░ ìİüìâüìùÉìä£ Ù╣äÛÀáìğêìä▒ìØä Ù│┤ìØ┤Ù®░, 1~4 mmìØİ ìáÇìïáÿİ© Û░òÙÅä ÙİÉÙèö Û│áìïáÿİ© Û░òÙÅä ÙÂÇì£ä(foci)ÙÑ╝ Ù│┤ìØ©ÙïñÛ│á Ù░ØÿİöÙïñ[15].
Ù│© ìù░ÛÁ¼ìùÉìä£ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ìğäÙï¿ìùÉ ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİü Û▓Çìé¼ìØİ Ù»╝Û░ÉÙÅäìÖÇ ÿè╣ìØ┤ÙÅäÙèö Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░® ìåîÛ▓¼Û│╝ Ù╣äÛÀáìğêìä▒ ìåîÛ▓¼ìùÉìä£ ÙåÆÛ▓î ÙéİÿâÇÙé¼ì£╝Ù®░, ìØ┤Ùèö 2012Ùàä Sun Ùô▒[9]ìØİ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÿÖİìŞÉìùÉìä£ ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìùÉìä£ Ù│┤ìØ┤Ùèö Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░® Ù╣äÛÀáìğêìä▒ ìåîÛ▓¼ìØ┤ ÙåÆìØÇ Ù»╝Û░ÉÙÅäÙÑ╝ Ù│┤ìØ©ÙïñÙèö Û▓░Û│╝ìÖÇ ìØ╝ì╣İÿò£Ùïñ. Sun Ùô▒ [9]ìØÇ, ÙæÉ Ù¬àìØİ ÿÅëÛ░ÇìŞÉÛ░Ç ÿîÉÙï¿ÿòİìİÇìØä Ùòî ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİü Û▓Çìé¼ìâü ìØ┤ÿòİìäáìØİ Ù╣äÛÀáìğêìä▒(Ù»╝Û░ÉÙÅä 88.2%/91.2%; ÿè╣ìØ┤ÙÅä 100%/90.9%). Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░® ìåîÛ▓¼(Ù»╝Û░ÉÙÅä 82.3%/82.3%; ÿè╣ìØ┤ÙÅä 100%/90.9%) ÿò¡Ù¬®ìØÇ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ìğäÙï¿Û│╝ ÙåÆìØÇ ìù░Û┤ÇÛ┤ÇÛ│äÙÑ╝ Û░ÇìğäÙïñÛ│á Ù│┤Û│áÿòİìİÇÙïñ. Sun Ùô▒ [9]ìØİ ìù░ÛÁ¼ìùÉìä£Ùèö Û┤æÙ▓öì£äÿò£ ìäØÿÜîÿÖö ìåîÛ▓¼ìØ┤ Ù»╝Û░ÉÙÅä 29.4%/35.2%; ÿè╣ìØ┤ÙÅä 100%/100%Ùí£ ÙåÆìØÇ ÿè╣ìØ┤ÙÅäÙÑ╝ Ù│┤ìØ©ÙïñÛ│á Ù│┤Û│áÙÉİìùêì£╝Ùéİ, Ù│© ìù░ÛÁ¼ìùÉìä£Ùèö Û┤æÙ▓öì£äÿò£ ìäØÿÜîÿÖö ìåîÛ▓¼ìØä Ù│┤ìØ© ÿÖİìŞÉÙèö Û▒┤ìí░ ìĞØìâüÛÁ░ìùÉìä£Ùèö ìùåìùêÛ│á, ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÛÁ░ìùÉìä£ 1Ù¬à ÿÖòìØ©ÙÉİìû┤ 100% Ù»╝Û░ÉÙÅäÙÑ╝ Ù│┤ìİÇÙïñ. ÿòİìğÇÙğî ÿò┤Ùï╣ ÿÖİìŞÉ ìêİÛ░Ç ìáüìû┤ ÿåÁÛ│äìáü ì£áìØİìä▒ìØä ÿÖòìØ©ÿòá ìêİ ìùåìùêÙïñ[9].
ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ìğäÙï¿Û©░ìñÇìØİ Û░ü ÿò¡Ù¬®Û│╝ ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİü ìåîÛ▓¼Û│╝ìØİ ìâüÛ┤ÇÛ┤ÇÛ│äìùÉ ÙîÇÿò£ ÙÂäìäØìùÉìä£Ùèö ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüÛ│╝ ìŞäìâüìĞØìâü, ÿİêì▓¡ÿòÖìáü Û▓Çìé¼ìØİ ìâüÛ┤ÇÛ┤ÇÛ│äÙÑ╝ ÿÖòìØ©ÿòá ìêİ ìŞêìùêì£╝Ùéİ, ìàöÙ¿© Û▓Çìé¼, Ù╣äìŞÉÛÀ╣ ÿâÇìòíìåıÙÅä Û▓Çìé¼, ìåîÿâÇìòíìäá ìí░ìğü Û▓Çìé¼ìùÉìä£Ùèö ìâüÛ┤ÇÛ┤ÇÛ│äÙÑ╝ ÿÖòìØ©ÿòá ìêİ ìùåìùêÙïñ. Ù│© ìù░ÛÁ¼Û░Ç Ù¬¿Ùôá ÿÖİìŞÉìùÉìä£ Ù¬¿Ùôá Û▓Çìé¼ÙÑ╝ ìï£ÿûëÿòİìğÇ Ù¬╗ÿòİìİÇÛ│á, ÿè╣ÿŞê Û┤æÙ▓öì£äÿò£ ìäØÿÜîÿÖö ìåîÛ▓¼ìØä Ù│┤ìØ© ÿÖİìŞÉÛ░Ç 1Ù¬àì£╝Ùí£ ÙéİÿâÇÙé¼Ùïñ. ìÂöÿøä ìØ┤ìùÉ ÙîÇÿò£ ìÂöÛ░ÇìáüìØ© ìù░ÛÁ¼Û░Ç ìğäÿûëÙÉİìû┤ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ìğäÙï¿Û©░ìñÇìØİ Û░ü ÿò¡Ù¬®Û│╝ ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİü ìåîÛ▓¼ìØİ ìâüÛ┤ÇÛ┤ÇÛ│äÙÑ╝ ÿÖòìØ©ÿò£ÙïñÙ®┤, ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ìğäÙï¿ìùÉìä£ìØİ ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØİ ìğäÙï¿ìáü Û░Çì╣İÙÑ╝ Ùıö Ù¬àÿÖòÿŞê ÿòá ìêİ ìŞêìØä Û▓âì£╝Ùí£ ìâØÛ░üÙÉ£Ùïñ.
ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÿÖİìŞÉìùÉìä£Ùèö Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░®ìí░ìğü ì╣¿ì░®ìØ┤ ìûæì©í Ù¬¿ÙæÉ Ù░£ìâØÿòá ìêİ ìŞêÛ│á, ÙÂÇÙÂäìáüìØ┤Û▒░Ùéİ ÙÂêÛÀáìğêÿòİÛ▓î ÙéİÿâÇÙéá ìêİ ìŞêÛ│á ìğêÿÖİìØ┤ ìğäÿûëÿò¿ìùÉ Ùö░ÙØ╝ ìØ┤ÿòİìäáìØİ ÙğÄìØÇ ÙÂÇÙÂäìØä ì░¿ìğÇÿòá ìêİÙÅä ìŞêÙïñ. ìğêÿÖİìØ┤ ìğäÿûëÿòİÙ®┤ìä£ ÛÀáìğêÿòİÛ▓î ÙÂäÿżÿòİÙıİ ìğÇÙ░®ìä©ÿżÛ░Ç ÿè╣ìáò ìğÇìù¡ìùÉ ìîôìØ┤Û▓î ÙÉİÙ®┤ìä£ ìŞÉÛ©░Û│ÁÙ¬àìİüìâü Û▓Çìé¼Ùéİ ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìâü ÿÖòìØ©ÙÉİÙèö Û▓âì£╝Ùí£ ìâØÛ░üÙÉ£Ùïñ[8]. ìòàÿòİìäáìØÇ Ù╣äìŞÉÛÀ╣ ìï£ìùÉ ÿâÇìòíìØİ ÙÂäÙ╣äìùÉ ìú╝ ìù¡ÿòáìØä ÿòİÛ│á, ìØ┤ÿòİìäáìØÇ ìŞÉÛÀ╣ ìï£ìùÉ ÿâÇìòíìØİ ÙÂäÙ╣äìùÉ ìú╝ ìù¡ÿòáìØä ÿòİÙèöÙı░[16], ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØÇ ì┤êÛ©░ìùÉÙèö ìØ┤ÿòİìäáÙ│┤ÙïñÙèö ìòàÿòİìäáÛ│╝ ìäñÿòİìäáìØİ Û©░ÙèÑìØ┤ ìú╝Ùí£ Ùû¿ìû┤ìğÇÙèö ìûæìâüìØä Ù│┤ìØ┤Ù®░, ìğêÿÖİìØ┤ ìğäÿûëÿòİÙ®┤ìä£ ìØ┤ÿòİìäáìØİ Û©░ÙèÑÙÅä Ùû¿ìû┤ìğÇÙèö ìûæìâüìØä Ù│┤ìØ©Ùïñ[17]. Ù│© ìù░ÛÁ¼ìùÉìä£Ùèö ìòàÿòİìäáìØä ìù░ÛÁ¼ÿòİìğÇÙèö ìòèìòİìğÇÙğî, ÿûÑÿøä ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░Û│╝ ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìùÉìä£ ìòàÿòİìäá ìåîÛ▓¼ìùÉ ÙîÇÿò£ ìù░ÛÁ¼Û░Ç ìØ┤Ùú¿ìû┤ìğäÙïñÙ®┤ ìğäÙï¿ìáü Û░Çì╣İÙÑ╝ ÙåÆìØ╝ ìêİ ìŞêìØä Ù┐ÉÙğî ìòäÙïêÙØ╝ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØİ Ù│æÛ©░ìùÉ ÙîÇÿò£ ìù░ÛÁ¼ÙÅä ìØ┤Ùú¿ìû┤ìğê ìêİ ìŞêìØä Û▓âì£╝Ùí£ ìâØÛ░üÙÉ£Ùïñ.
ROC ÙÂäìäØìùÉìä£Ùèö ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØİ ìğäÙï¿ìáü ìïáÙó░ÙÅäÙèö Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░® ìåîÛ▓¼ìØ┤ Û░ÇìŞÑ ÙåÆìØÇ Û▓âì£╝Ùí£ ÙéİÿâÇÙé¼ì£╝Ù®░, ÙïñìØîì£╝Ùí£ ìØ┤ÿòİìäáìØİ Ù╣äÛÀáìğêìä▒ ìåîÛ▓¼ÙÅä ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìùÉ ÙåÆìØÇ ìğäÙï¿ìáü Û░Çì╣İÛ░Ç ìŞêÙèö Û▓âì£╝Ùí£ ÿîÉÙï¿ÿòá ìêİ ìŞêÙïñ.
Ù│© ìù░ÛÁ¼ìØİ ÿò£Û│äìáÉì£╝Ùí£Ùèö 1Ù¬àìØİ ìİüìâüìØİÿòÖÛ│╝ ìáäÙ¼©ìØİÛ░Ç ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØİ ÿîÉÙÅàìØä ÿòİìİÇÛ©░ ÙòîÙ¼©ìùÉ ìù¼Ùş¼ Ù¬àìØİ Û▓Çìé¼ìŞÉ Û░ä Ù╣äÛÁÉÙÑ╝ ÿòİìğÇ Ù¬╗ÿò£ ìáÉìØ┤ ìŞêìØä ìêİ ìŞêÙïñ. ÙİÉÿò£ ÿøäÿûÑìáü ìù░ÛÁ¼Ùí£ ìï£ÿûëÿòİìİÇÛ©░ ÙòîÙ¼©ìùÉ Ù¬¿Ùôá ÿÖİìŞÉìùÉìä£ 2016Ùàä ACR/EULAR ÙÂäÙÑİÛ©░ìñÇìØİ 5Û░ÇìğÇ Û▓Çìé¼ ÿò¡Ù¬® Ù¬¿ÙæÉÙÑ╝ ìï£ÿûëÿòİìğÇ Ù¬╗ÿò£ ìáÉìØ┤ ÿò£Û│äÙí£ ìŞæìÜ®ÿò£Ùïñ. ÛÀ©ÙмÛ│á ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØİ Û▓¢ìÜ░ Ù░®ìé¼ìäá ìí░ìé¼ìØİ ì£äÿùİìä▒ì£╝Ùí£ ìØ©ÿò┤ ìŞäìâüìáüì£╝Ùí£ ì┤êÛ©░ Û▓Çìé¼Ùí£ ìØ┤ìÜ®ÿòİÛ©░ ìû┤ÙáñìÜ┤ ÿò£Û│äÛ░Ç ìŞêÙïñ. ÙğêìğÇÙğëì£╝Ùí£ ìáäì▓┤ ÿÖİìŞÉ ÙîÇìâüÛÁ░ìØä Û▒┤ìí░ ìĞØìâüì£╝Ùí£ Ùé┤ìøÉÿò£ ÿÖİìŞÉÙí£ ÿòİìİÇÛ©░ ÙòîÙ¼©ìùÉ, Ù¬àÿÖòÿò£ Ù¼┤ìĞØìâüìØİ ÙîÇìí░ÛÁ░Û│╝ìØİ Ù╣äÛÁÉÛ░Ç ìùåìùêÙıİ Û▓âÙÅä Ù│© ìù░ÛÁ¼ìØİ ÿò£Û│äìáÉìØ┤Ùïñ.
ÿİêì▓¡ÿòÖìáü Û▓Çìé¼Ùéİ ìåîÿâÇìòíìäáìØİ ìí░ìğü Û▓Çìé¼ ìåîÛ▓¼ ìùåìØ┤ ìáäìé░ÿÖö Ùï¿ì©Áì┤¼ìİüìùÉìä£ ìØ┤ÿòİìäáìØİ Ù╣äÛÀáìğêìä▒Û│╝ Û┤æÙ▓öì£äÿò£ Ù╣äìáòìâüìáü ìğÇÙ░®ìí░ìğü ì╣¿ì░® ìåîÛ▓¼Ùğî Ù│┤ìØ©ÙïñÛ│á ÿò┤ìä£ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØä ìğäÙï¿ÿòá ìêİ ìŞêÙèö Û▓âìØÇ ìòäÙïêÙïñ. ÿòİìğÇÙğî, ìØ┤ÿòİìäá ìáäìé░ÿÖöÙï¿ì©Áì┤¼ìİüìØÇ ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ìØİ ìğäÙï¿ìùÉ ÙÅäìøÇìØä ìñä ìêİ ìŞêì£╝Ù®░, ìØ┤ÿòİìäáìØİ Ù╣äÛÀáìğêìä▒ ìåîÛ▓¼Û│╝ Ù╣äìáòìâüìáü ìğÇÙ░® ìí░ìğü ì╣¿ì░® ìåîÛ▓¼ìØÇ ÙåÆìØÇ Ù»╝Û░ÉÙÅäìÖÇ ÿè╣ìØ┤ÙÅäÙÑ╝ Ù│┤ìØ┤Û│á, ìğäÙï¿ìáü Û░Çì╣İÛ░Ç ÙåÆìòä ìç╝ÛÀ©Ùáî ìĞØÿøäÛÁ░ ÿÖİìŞÉÙÑ╝ ìğäÙï¿ÿò¿ìùÉ ìŞêìû┤ ìØİÙ»© ìŞêÙèö ìáòÙ│┤ÙÑ╝ ìá£Û│Áÿòá ìêİ ìŞêÙïñ.
Supplementary MaterialsThe Data Supplement is available with this article at https://doi.org/10.3342/kjorl-hns.2019.00367.
Supplementary┬áTable┬á1.American College of Rheumatology/European League Against Rheumatism classification criteria for primary SS: the classification of primary SS applies to any individual who meets the inclusion criteria,*does not have any of the conditions listed as exclusion criteria,ÔÇáand has a score of ÔëÑ 4 when the weights from the five criteria items below are summed NotesAuthor Contribution Conceptualization: Ji Won Kim. Data curation: Soo Hyun Joo. Formal analysis: Hyung Sun Hong. Investigation: Hyung Sun Hong. Methodology: Young-Hye Kang. Project administration: Young-Mo Kim. Resources: Mie Jin Lim. Supervision: Jeong-Seok Choi. Validation: Ji Won Kim. Visualization: Hong-Ju Kim. WritingÔÇöoriginal draft: Hyung Sun Hong. WritingÔÇöreview & editing: Ji Won Kim. Fig.┬á1.Manifestations of parotid gland CT in Sj├ÂgrenÔÇÖs syndrome. Normal parotid gland on CT (A). Heterogeneous parotid gland (B, arrowheads: ill-defined area with soft-tissue attenuation). Fat tissue deposition (C, arrows: the heterogeneous diffuse abnormal adipose tissue accumulation on parotid gland). Diffuse calcification (D, circles: calcifications are observed as high attenuation on parotid gland). 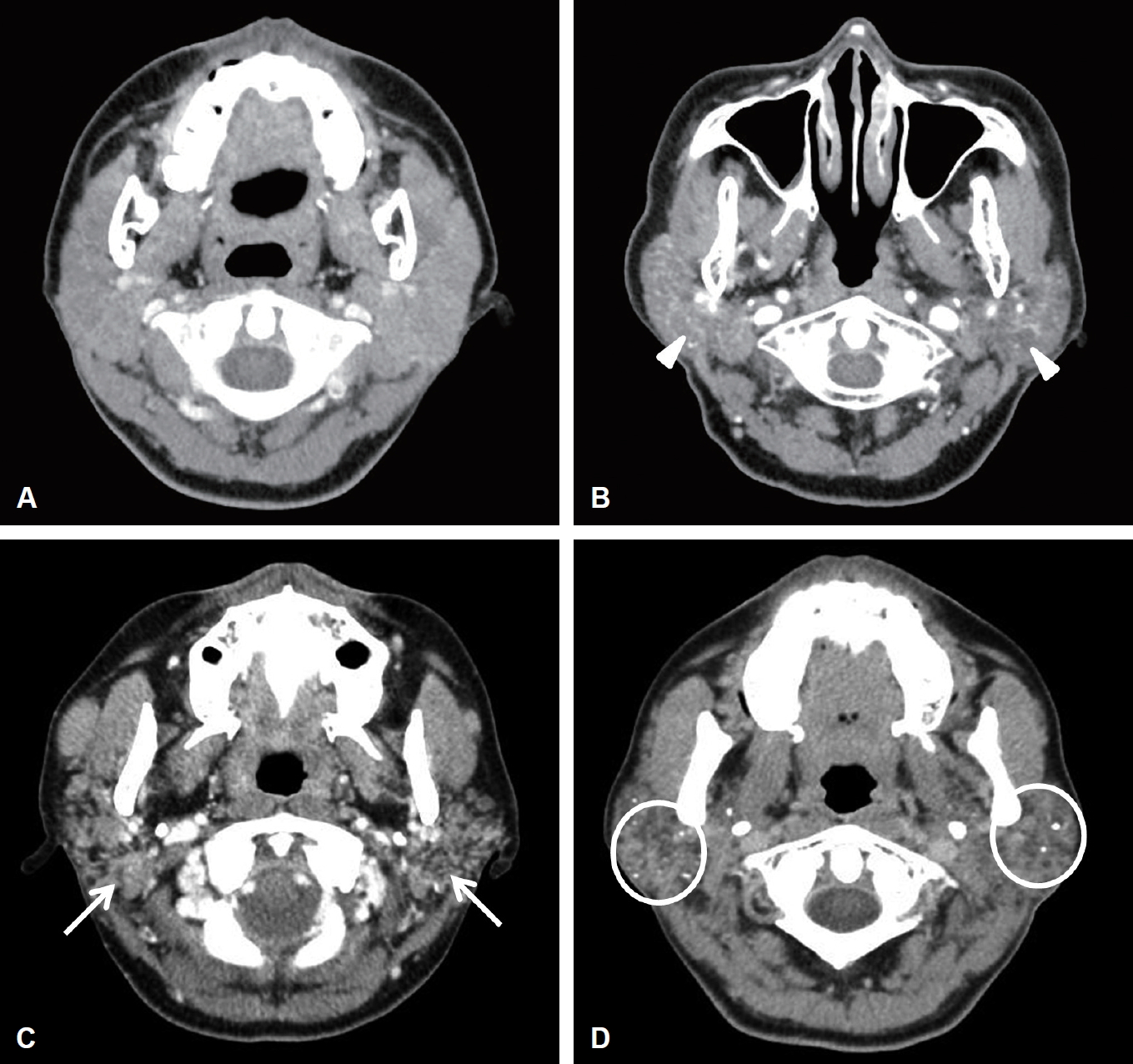
Fig.┬á2.Receiver operating characteristic curve for quantitative measurements on parotid CT to differentiate Sj├ÂgrenÔÇÖs syndrome. The areas under the curves, which indicate the diagnostic ability. AUC: area under the curve. 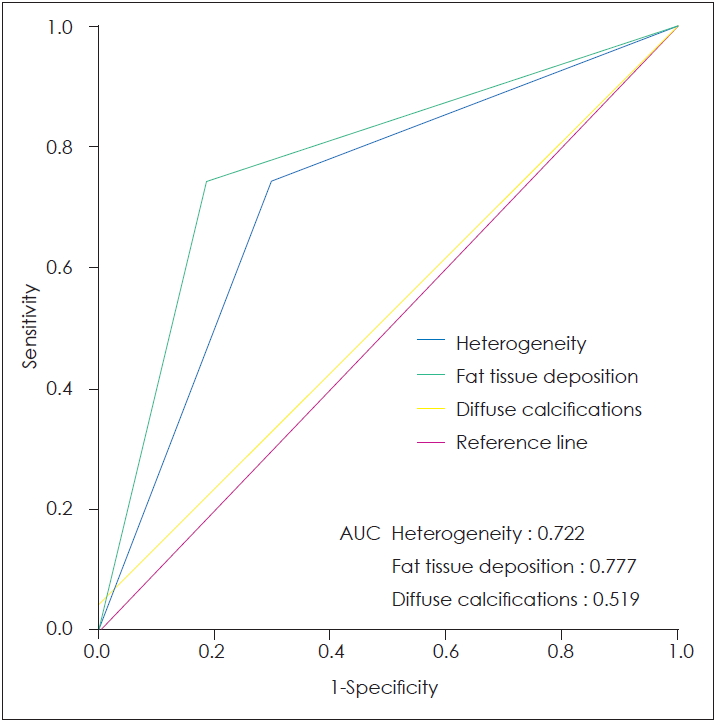
Table 1.Patients characteristics (n=91)
Table┬á2.Diagnostic accuracy of parotid CT for Sj├ÂgrenÔÇÖs syndrome REFERENCES1. Vitali C, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE, et al. Classification criteria for Sj├ÂgrenÔÇÖs syndrome: A revised version of the European criteria proposed by the American-European consensus group. Ann Rheum Dis 2002;61(6):554-8.
2. Theander E, Henriksson G, Ljungberg O, Mandl T, Manthorpe R, Jacobsson LT. Lymphoma and other malignancies in primary Sj├ÂgrenÔÇÖs syndrome: A cohort study on cancer incidence and lymphoma predictors. Ann Rheum Dis 2006;65(6):796-803.
3. Shiboski SC, Shiboski CH, Criswell L, Baer A, Challacombe S, Lanfranchi H, et al. American College of Rheumatology classification criteria for Sj├ÂgrenÔÇÖs syndrome: A data-driven, expert consensus approach in the Sj├ÂgrenÔÇÖs International Collaborative Clinical Alliance cohort. Arthritis Care Res (Hoboken) 2012;64(4):475-87.
4. Shiboski CH, Shiboski SC, Seror R, Criswell LA, Labetoulle M, Lietman TM, et al. 2016 American College of Rheumatology/European League Against Rheumatism classification criteria for primary Sj├ÂgrenÔÇÖs syndrome: A consensus and data-driven methodology involving three international patient cohorts. Ann Rheum Dis 2017;76(1):9-16.
5. Goules AV, Tzioufas AG. Imaging: Diagnostic value of ultrasonography in Sj├ÂgrenÔÇÖs syndrome. Nat Rev Rheumatol 2014;10(8):450-2.
6. Cornec D, Jousse-Joulin S, Saraux A, Devauchelle-Pensec V. Salivary gland ultrasound to diagnose Sj├ÂgrenÔÇÖs syndrome: A claim to standardize the procedure. Rheumatology (Oxford) 2015;54(1):199-200.
7. Kim JW, Lee H, Park SH, Kim SK, Choe JY, Kim JK. Salivary gland ultrasonography findings are associated with clinical, histological, and serologic features of Sj├ÂgrenÔÇÖs syndrome. Scand J Rheumatol 2018;47(4):303-10.
8. Izumi M, Eguchi K, Nakamura H, Nagataki S, Nakamura T. Premature fat deposition in the salivary glands associated with Sj├Âgren syndrome: MR and CT evidence. AJNR Am J Neuroradiol 1997;18(5):951-8.
9. Sun Z, Zhang Z, Fu K, Zhao Y, Liu D, Ma X. Diagnostic accuracy of parotid CT for identifying Sj├ÂgrenÔÇÖs syndrome. Eur J Radiol 2012;81(10):2702-9.
10. Villa A, Wolff A, Narayana N, Dawes C, Aframian DJ, Lynge Pedersen AM, et al. World Workshop on Oral Medicine VI: A systematic review of medication-induced salivary gland dysfunction. Oral Dis 2016;22(5):365-82.
11. Daniels TE, Benn DK. Is sialography effective in diagnosing the salivary component of Sj├ÂgrenÔÇÖs syndrome? Adv Dent Res 1996;10(1):25-8.
12. Kalk WW, Vissink A, Spijkervet FK, Bootsma H, Kallenberg CG, Roodenburg JL. Parotid sialography for diagnosing Sj├Âgren syndrome. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002;94(1):131-7.
13. Izumi M, Eguchi K, Ohki M, Uetani M, Hayashi K, Kita M, et al. MR imaging of the parotid gland in Sj├ÂgrenÔÇÖs syndrome: A proposal for new diagnostic criteria. AJR Am J Roentgenol 1996;166(6):1483-7.
14. Takagi Y, Sumi M, Sumi T, Ichikawa Y, Nakamura T. MR microscopy of the parotid glands in patients with SjogrenÔÇÖs syndrome: Quantitative MR diagnostic criteria. AJNR Am J Neuroradiol 2005;26(5):1207-14.
15. Baer AN, Walitt B. Sj├Âgren syndrome and other causes of Sicca in older adults. Clin Geriatr Med 2017;33(1):87-103.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 |
 |