ņä£ ļĪĀ
ļģĖĒÖöņä▒ ļé£ņ▓Ł(age-related hearing loss, Presbycusis)ņØĆ ļģĖĒÖöņŚÉ ņØśĒĢ£ Ēć┤Ē¢ēņä▒ ļ│ĆĒÖöļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢśļŖö ļé£ņ▓Łņ£╝ļĪ£, 65ņäĖ ņØ┤ņāüņØś Ļ│ĀļĀ╣ņŚÉņä£ ļ░£ņāØĒĢśļŖö ĒØöĒĢ£ ļ¦īņä▒ ņ¦łĒÖśņØ┤ļŗż. ņĀäĒśĢņĀüņØĖ ĒŖ╣ņ¦Ģņ£╝ļĪ£ļŖö ņä£ņä£Ē׳ ņ¦äĒ¢ēĒĢśļŖö ņ¢æņĖĪņØś ļīĆņ╣ŁņĀüņØĖ ņ▓ŁļĀźņĀĆĒĢśĻ░Ć ņŻ╝ļĪ£ Ļ│ĀņŻ╝Ēīīņłś ņśüņŚŁņŚÉ ļéśĒāĆļéśļŖö Ļ▓āņØ┤ļŗż[1]. ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśĻ░Ć ļģĖĒÖöĒśäņāüĻ│╝ Ļ┤ĆļĀ©ļÉ£ļŗżļŖö Ļ▓āņØĆ ņל ņĢīļĀżņĀĖ ņ׳ļŗż. ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņÖĆņØś ļÅģļ”ĮņĀü ņŚ░Ļ┤Ćņä▒ņØĆ ļģĖĒÖöņä▒ ļé£ņ▓ŁņØ┤ ņ╣śļ¦żņØś ņøÉņØĖņØ┤ ļÉĀ ņłś ņ׳ļŗżļŖö Ļ░ĆņäżņØ┤ ņĀ£ņŗ£ļÉśļ®┤ņä£ 30ļģä ņĀä ņ▓śņØī ļ│┤Ļ│ĀļÉśņŚłļŗż[2]. ĻĘĖļÅÖņĢł ņØ┤ļ╣äņØĖĒøäĻ│╝ ņĀäļ¼ĖņØśņÖĆ ņŗĀĻ▓ĮĻ│╝ ņĀäļ¼ĖņØś, ĻĘĖļ”¼Ļ│Ā ņŚŁĒĢÖņ×ÉļōżĻ│╝ ņØĖņ¦ĆĻ│╝ĒĢÖņ×ÉļōżņØś ĻĄÉļźśĻ░Ć ņĀüņ¢┤ņä£ ĻĘĖ Ļ┤ĆļĀ©ņä▒ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļČĆņĪ▒Ē¢łļŗż. ĻĘĖļ¤¼ļéś ņĄ£ĻĘ╝ņŚÉ ņØ┤ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒÖ£ļ░£ĒĢ┤ņ¦ĆĻ│Ā ņ׳Ļ│Ā ļ¦ÄņØĆ ņ▓┤Ļ│äņĀü ļ”¼ļĘ░ ļ░Å ļ®öĒāĆ ļČäņäØņŚÉ ļīĆĒĢ£ ļģ╝ļ¼ĖņŚÉņä£ ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦ż ņ£äĒŚśņØś ņ”ØĻ░Ć ļō▒ņŚÉ Ļ┤ĆĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ļŗż[3-5]. Loughrey ļō▒[3]ņØĆ 20264ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ 36Ļ░£ņØś ņŚ░ĻĄ¼ļōżņØä ļ®öĒāĆ ļČäņäØĒĢśņŚ¼ ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦żņŚÉ ļīĆĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļČäņäØĒĢśņśĆĻ│Ā, ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś[odds ratio(OR), 1.22; 95% confidence interval (CI), 1.09~1.36]ņÖĆ ņ╣śļ¦ż[OR, 1.28; 95% CI, 1.02~1.59]ņÖĆņØś ņ£ĀĒÜ©ĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļśÉĒĢ£ ņ╣śļ¦żņŚÉ ļīĆĒĢ£ 9Ļ░Ćņ¦Ć Ļ▒┤Ļ░Ģ ļ░Å ņāØĒÖ£ņŖĄĻ┤Ć ņÜöņØĖ ņżæ, ļé£ņ▓ŁņØĆ Ļ░Ćņן Ēü░ ņ×Āņ×¼ļĀźņØä ņ¦Ćļŗī ņłśņĀĢ Ļ░ĆļŖźĒĢ£ ņ£äĒŚś ņÜöņåīļĪ£ ļĮæĒśöļŗż[6]. ĻĘĖļ¤¼ļéś ņĢäņ¦ü ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś Ļ┤ĆļĀ©ņä▒ņŚÉ ļīĆĒĢ£ ņøÉņØĖ ļ®öņ╗żļŗłņ”śņØĆ ļ¬ģĒÖĢĒ׳ ļ░ØĒśĆņ¦Ćņ¦Ć ņĢŖņĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś ņŚ░Ļ┤Ćņä▒ ļ░Å ņøÉņØĖ ļ®öņ╗żļŗłņ”śņØä ņĄ£ĻĘ╝ ļģ╝ļ¼Ė ļ”¼ļĘ░ļź╝ ĒåĄĒĢ┤ ņĀĢļ”¼ĒĢśĻ│Ā, ļéśņĢäĻ░Ć ņ▓ŁĻ░üņĀü ņżæņ×¼Ļ░Ć ņØĖņ¦ĆĻĖ░ļŖźņŚÉ ņ׳ņ¢┤ ņ¢┤ļ¢ż ņśüĒ¢źņØä ļ»Ėņ╣Āņ¦ĆņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
ļ│Ė ļĪĀ
ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś Ļ┤ĆļĀ©ņä▒
ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢśņØś Ļ┤ĆļĀ©ņä▒ņØä ļ│┤ņŚ¼ņŻ╝ļŖö ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ļŖöļŹ░, ņŻ╝ļĪ£ ļģĖĒÖöņä▒ ļé£ņ▓ŁņŚÉ ņØ┤ĒÖśļÉ£ Ļ▓ĮņÜ░ ņ╣śļ¦żļ░£ņāØ ņ£äĒŚśņØ┤ ņ”ØĻ░ĆĒĢĀ ņłś ņ׳ļŗżļŖö Ļ▓āņØ┤ļŗż. Lin ļō▒[7]ņØĆ 25 dB HL ņØ┤ņāüņØś ļé£ņ▓ŁņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņ▓ŁļĀźņŚŁņ╣śĻ░Ć 10 dBņö® ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ╣śļ¦ż ļ░£ņāØ ņ£äĒŚśņØ┤ 20%ņö® ņ”ØĻ░ĆĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒ¢łļŗż. ņĄ£ĻĘ╝ņŚÉ Gurgel ļō▒[8]ņØĆ 65ņäĖ ņØ┤ņāüņØś ļģĖņØĖņŚÉņä£ ņ▓ŁļĀźņØ┤ ņĀĢņāüņØĖ Ļ▓ĮņÜ░ ņ╣śļ¦żļĪ£ ņØ┤ĒÖśļÉśļŖöļŹ░ Ļ▒Ėļ”¼ļŖö ņŗ£Ļ░äņØ┤ 11.9ļģäņØĖļŹ░ ļ░śĒĢ┤, ļé£ņ▓ŁņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉļŖö 10.3ļģäņØ┤ Ļ▒Ėļ”░ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. Ļ▓īļŗżĻ░Ć ļ¬ć Ļ░Ćņ¦Ć ņØĖņ¦Ć Ļ▓Ćņé¼ ņĀÉņłśĻ░Ć ļé£ņ▓ŁņØś ņ”ØĻ░Ć ņĀĢļÅäņŚÉ ļö░ļØ╝ ņäĀĒśĢņ£╝ļĪ£ Ļ░ÉņåīĒĢ£ļŗżļŖö ļ│┤Ļ│ĀļōżļÅä ņ׳ļŗż[9]. ļģĖņØĖļōżņŚÉņä£ ņŗ¼ļÅä ļé£ņ▓ŁĻ│╝ ļé«ņØĆ ĻĖ░ņ¢ĄļĀź ļ░Å ņŗżĒ¢ēļŖźļĀź ņé¼ņØ┤ņØś ņ£ĀĒÜ©ĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ¢Ėņ¢┤ņĀü, ļ╣äņ¢Ėņ¢┤ņĀü ņØĖņ¦ĆĻĖ░ļŖź ĒÅēĻ░Ćļź╝ ĒåĄĒĢ┤ ļ░ØĒśĆņĪīļŗż[10-13].
ņØ┤ļĀćļō» ļģĖĒÖöņä▒ ļé£ņ▓ŁņØĆ ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦ż ļ░£ņāØĻ│╝ ļÅģļ”ĮņĀüņ£╝ļĪ£ ņŚ░Ļ┤ĆļÉ£ļŗżĻ│Ā ĒĢĀ ņłś ņ׳ļŗż. ĒŖ╣Ē׳ ņ▓ŁļĀźņØ┤ ņĀĢņāüņØĖ Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢ┤, Ļ▓ĮļÅä, ņżæļō▒ļÅä, ņŗ¼ļÅä ļé£ņ▓ŁņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉ ņ╣śļ¦ż ļ░£ņāØ ņ£äĒŚśņØ┤ Ļ░üĻ░ü 2ļ░░, 3ļ░░, 5ļ░░ ņØ┤ņāü ņ”ØĻ░ĆĒĢ£ļŗż[14,15]. ņØ┤ļĀćĻ▓ī ļé£ņ▓ŁņØ┤ ņ╣śļ¦ż ļ░£ņāØņØś ņ£äĒŚśņÜöņØĖņ£╝ļĪ£ ņŚ¼Ļ▓©ņ¦ĆĻ▓ī ļÉ£ Ļ▓āņØĆ ņĄ£ĻĘ╝ņØś ņØ╝ņØ┤ļ®░, ņĄ£ĻĘ╝ņØś ņĀäĒ¢źņĀü ņĮöĒśĖĒŖĖ ņŚ░ĻĄ¼ņŚÉņä£ ļé£ņ▓ŁņØ┤ ļÅģļ”ĮņĀüņØĖ ņ╣śļ¦ż ļ░£ņāØņØś ņ£äĒŚśņÜöņØĖņ×äņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ļŗż[7,8,16,17]. Ļ░£ņ▓┤ĻĄ░ ĻĘĆņåīļČäĒÜŹ(population attributable fraction, PAF)ņØ┤ļ×Ć ņŻ╝ņ¢┤ņ¦ä ĻĖ░Ļ░ä ļÅÖņĢł ļé£ņ▓ŁĻ│╝ Ļ░ÖņØĆ ņ£äĒŚś ņÜöņØĖņØ┤ ņĀ£Ļ▒░ļÉśņŚłņØä ļĢī, ņ╣śļ¦ż ļ░£ņāØņØ┤ Ļ░ÉņåīĒĢśļŖö ļ╣äņ£©ņØä ļéśĒāĆļé┤ļ®░, ņ╣śļ¦ż ļ░£ņāØņŚÉņä£ ļé£ņ▓ŁņØś PAFļŖö 23.0%ļĪ£ ņØ┤ļŖö, ņÜ░ņÜĖ(10.1%), ņé¼ĒÜīņĀü Ļ│Āļ”Į(5.9%), ĒØĪņŚ░(13.9%), Ļ│ĀĒśłņĢĢ(5.1%), ļŗ╣ļć©(3.2%) ļō▒ņØś ļŗżļźĖ ņ£äĒŚśņÜöņØĖļōżļ│┤ļŗż Ļ░Ćņן ļåÆņØĆ ņłśņ╣śņØ┤ļŗż[6]. ņØ┤ļĀćļō» ļé£ņ▓ŁņØ┤ ņ╣śļ¦ż ļ░£ņāØņŚÉ ņ׳ņ¢┤ ļåÆņØĆ ņ£äĒŚśļźĀņØä Ļ░Ćņ¦Ćļ®░, ĻĘĖ ļ░£ņāØļźĀņØ┤ ļģĖņØĖņŚÉĻ▓īņä£ ļåÆĻ│Ā, ņēĮĻ▓ī ņ¦äļŗ©ĒĢĀ ņłś ņ׳Ļ│Ā, ļ│┤ņ▓ŁĻĖ░ Ļ░ÖņØĆ ņ▓ŁĻ░üņĀü ņżæņ×¼ļĪ£ ņ╣śļŻī Ļ░ĆļŖźĒĢśļŗżļŖö ņĀÉņŚÉņä£ ņ╣śļ¦żņØś ņśłļ░®ņØä ņ£äĒĢ£ ĒāĆĻ▓¤ņ£╝ļĪ£ ņé╝ņØä ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ĻĘĖ ņĀäņŚÉ ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņ╣śļ¦ż ņé¼ņØ┤ņØś ņĀĢĒÖĢĒĢ£ ņØĖĻ│╝Ļ┤ĆĻ│ä ņĀĢļ”ĮņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż.
ņØ┤ļ┐Éļ¦ī ņĢäļŗłļØ╝, ļģĖņØĖņŚÉĻ▓īņä£ ļé£ņ▓ŁņØĆ Ļ▒┤Ļ░ĢĒĢ£ ļģĖļģäņØä ņ£äĒĢ£ ņéČĻ│╝ Ļ┤ĆļĀ©ļÉ£ ļ¦ÄņØĆ ņśüņŚŁņØĖ ņé¼ĒÜī ņ░ĖņŚ¼, ņŗĀņ▓┤ ņØ┤ļÅÖņä▒, ĒÖ£ļÅÖņä▒, ļéÖņāü, ĒÖ£ļĀź, ņ╣śļ¦ż ļō▒ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śĻ▓ī ļÉ£ļŗż[2,18,19]. ņżæļō▒ļÅä ņØ┤ņāüņØś ļé£ņ▓ŁņØä Ļ░Ćņ¦ä Ļ▓ĮņÜ░ņŚÉ ņĀĢņāü ņä▒ņØĖņŚÉ ļ╣äĒĢ┤ ļŹö ļé«ņØĆ ņŗĀņ▓┤ ĒÖ£ļÅÖņä▒ņØä Ļ░Ćņ¦ĆļŖöļŹ░ ņØ┤ļŖö ņé¼ĒÜīņĀü Ļ│Āļ”Į ļĢīļ¼ĖņØ┤ļŗż. ņ▓ŁĻ░üņןņĢĀļŖö ņØĖņ¦ĆņĀü Ļ│╝ļČĆĒĢśļź╝ ņØ╝ņ£╝ņ╝£ņä£ ņ×ÉņäĖļéś ĻĘĀĒśĢņØä ņ£Āņ¦ĆĒĢśļŖöļŹ░ ņżæņÜöĒĢ£ ņŻ╝ņØśļĀźĻ│╝ ņØĖņ¦ĆļĀźņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śĻ▓ī ļÉ£ļŗż. ņ▓ŁĻ░üņןņĢĀĻ░Ć ņ▓ŁĻ░üņĀü ĒÖśĻ▓ĮņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ļ¬©ļŗłĒä░ĒĢśĻ│Ā ĒīīņĢģĒĢśļŖöļŹ░ ņĀ£ĒĢ£ņØä ņØ╝ņ£╝ņ╝£ņä£ ņŗĀņ▓┤ņĀü ĒÖ£ļÅÖ ņłśĒ¢ēņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śĻ▓ī ļÉ£ļŗż. ļśÉļŖö ņ▓ŁļĀźĻ│╝ ņŗĀņ▓┤ņĀü ĒÖ£ļÅÖņŚÉ ļÅÖņŗ£ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ļ│ĄĒåĄņĀü ļ│æļ”¼ĻĖ░ņĀäņØ┤ ņ׳ļŗżĻ│ĀļÅä ĒĢĀ ņłś ņ׳ļŗż. ņ”ē, ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØĆ ļé£ņ▓Ł ļ┐É ņĢäļŗłļØ╝ Ļ▒┤Ļ░ĢņĢģĒÖöņÖĆ ņŗĀņ▓┤ĒÖ£ļÅÖ ņĀĆĒĢśļź╝ ņØ╝ņ£╝Ēé©ļŗż[20]. Ļ│ĄĒåĄņØś ņŗĀĻ▓ĮĒĢÖņĀü Ēć┤Ē¢ēņØ┤ ņÖĆņÜ░ņÖĆ ĻĘĀĒśĢņ£Āņ¦ĆņŚÉ ĒĢäņłśņĀüņØĖ ņĀäņĀĢĻĖ░Ļ┤ĆņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗżĻ│Ā ĒĢĀ ņłś ņ׳ņ£╝ļ®░ ņØ┤ļŖö ļé£ņ▓ŁĻ│╝ ņŗĀņ▓┤ ĒÖ£ļÅÖ ņĀĆĒĢśņØś Ļ┤ĆļĀ©ņä▒ņØä ņäżļ¬ģĒĢĀ ņłś ņ׳ļŗż.
ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś ņŚ░Ļ┤Ćņä▒ņŚÉ ļīĆĒĢ£ Ļ░ĆļŖźĒĢ£ ļ®öņ╗żļŗłņ”ś
Causal mechanism
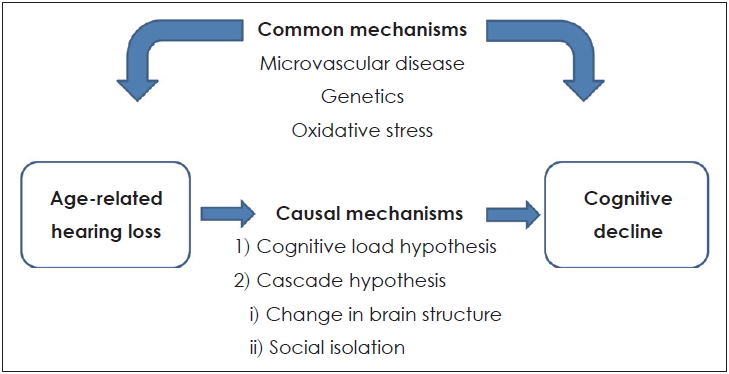
ņØ┤ļŖö ļģĖĒÖöņä▒ ļé£ņ▓ŁņŚÉ ņØśĒĢ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśĻ░Ć ļ░£ņāØĒĢ£ļŗżļŖö Ļ▓āņ£╝ļĪ£, ņØ┤ ļæśņØś Ļ┤ĆĻ│äĻ░Ć ņØĖĻ│╝Ļ┤ĆĻ│äļØ╝ļŖö Ļ░ĆņäżņØ┤ļŗż. ļģĖĒÖöņä▒ ļé£ņ▓ŁņØ┤ ņ╣śļ¦żņŚÉ ĻĖ░ņŚ¼ĒĢĀ ņłś ņ׳ņØīņØä ļ│┤ņŚ¼ņŻ╝ļŖö ļ¬ć Ļ░Ćņ¦Ć ņ×Āņ×¼ņĀüņØĖ ņøÉņØĖ Ļ░ĆņäżņØ┤ ņ׳ļŗż(Fig. 1). ņØ┤ņŚÉ ļīĆĒĢ┤ Ļ░ĆļŖźĒĢ£ Ļ░ĆņäżļĪ£ļŖö Cognitive load hypothesisņÖĆ Cascade hypothesis ļō▒ņØ┤ ņ׳ļŗż.
Cognitive load hypothesis
ņØ┤ Ļ░ĆņäżņØĆ ĻĄÉņ£Īņŗ¼ļ”¼ĒĢÖņŚÉņä£ ĻĖ░ņøÉĒĢ£ Ļ▓āņ£╝ļĪ£ 1998ļģä John SwellerļØ╝ļŖö ņŗ¼ļ”¼ĒĢÖņ×ÉņŚÉ ņØśĒĢ┤ Ļ│ĀņĢłļÉ£ Ļ▓āņØ┤ļŗż. ņØĖņ¦ĆņØś ļČĆĒĢś(cognitive load)ļ×Ć ņ×æņŚģ ņłśĒ¢ēņØä ņ£äĒĢ┤ Ļ░£ņØĖņØ┤ ĒĢäņÜöļĪ£ ĒĢśļŖö ņØĖņ¦ĆņĀü ļģĖļĀźņØ┤ļéś ņ▓śļ”¼ĒĢ┤ņĢ╝ ĒĢĀ ņĀĢļ│┤ņØś ņ¢æņØ┤ļŗż. ņ”ē, ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ņé¼ļ×īļōżņŚÉĻ▓ī ņ▓ŁņĘ© ļģĖļĀź(listening effort)ņØĆ ņ¢Ėņ¢┤ļź╝ ņØ┤ĒĢ┤ĒĢśĻĖ░ ņ£äĒĢ£ ņŻ╝ņØś ļ░Å ņ¦æņżæņØä ļ¦ÉĒĢśļ®░, ņØ┤ļ¤░ ļģĖļĀźņØä ĒĢŁņāü ĻĖ░ņÜĖņŚ¼ņĢ╝ ĒĢ£ļŗż. ļé£ņ▓ŁņØĆ ņ▓ŁĻ░ü ņŗĀĒśĖņØś Ļ░Éņåīļź╝ ņØ╝ņ£╝ĒéżĻ│Ā, ņ▓ŁĻ░ü ņØĖņ¦Ć Ļ│╝ņĀĢņØä ņ£äĒĢ┤ ļŹö ļ¦ÄņØĆ ņØĖņ¦Ć ņ×ÉņøÉņØä ĒĢäņÜöļĪ£ ĒĢśĻ│Ā, ļŗżļźĖ ņØĖņ¦Ć Ļ│╝ņĀ£ņŚÉ ņé¼ņÜ®ļÉśļŖö ņ×ÉņøÉņØä ņ▓ŁņĘ©ļģĖļĀź ņ¬Įņ£╝ļĪ£ ņĀäĒÖśĒĢśĻ▓ī ļÉśņ¢┤, Ļ▓░ĻĄŁ ņØĖņ¦ĆņĀü ņśłļ╣äņ£©(cognitive reserve) Ļ░Éņåīļź╝ ņ£Āļ░£ĒĢ£ļŗżļŖö Ļ░ĆņäżņØ┤ļŗż[21-24]. ņØ╝ņāü ņāØĒÖ£ņŚÉņä£ ņ▓ŁĻ░ü ņ¦ĆĻ░ü ņ▓śļ”¼ņŚÉ ņŤļŖö Ļ│╝ļÅäĒĢ£ ņØĖņ¦Ć ļČĆĒĢśĻ░Ć ļćīņØś ĻĄ¼ņĪ░ņĀü ļ│ĆĒÖöņÖĆ ļŗżļźĖ ņØĖņ¦Ć Ļ│╝ņĀĢņØś ņåÉņāüĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņŗĀĻ▓ĮņØś Ēć┤Ē¢ēņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗż. ņØ┤ĒøäņŚÉ ņ▓ŁĻ░üņĀü ņ¦ĆĻ░üņŚÉ ņØ┤ņÜ®ĒĢĀ ņłś ņ׳ļŖö ņØĖņ¦ĆņĀü ņ×ÉņøÉņØä Ļ░Éņåīņŗ£ņ╝£ ļé£ņ▓ŁņØä ņŗ¼ĒÖöņŗ£ĒéżĻ│Ā ņ¢Ėņ¢┤ ņØ┤ĒĢ┤ļź╝ Ļ░Éņåīņŗ£ĒéżļŖö ņĢģņł£ĒÖśņØ┤ ļ░£ņāØĒĢśĻ▓ī ļÉśņ¢┤ ļé£ņ▓Ł ĒÖśņ×ÉņŚÉņä£ ņØĖņ¦ĆņĀü ļČĆĒĢśļŖö ņ×æņŚģĻĖ░ņ¢ĄĻ│╝ Ļ░ÖņØĆ ļŗżļźĖ ņØĖņ¦ĆĻ│╝ņĀĢņ£╝ļĪ£ļČĆĒä░ ņØĖņ¦Ćņ×ÉņøÉņØä ņ▓ŁĻ░ü ņ¦ĆĻ░ü ņ¬Įņ£╝ļĪ£ ņĀäĒÖśņŗ£Ēé©ļŗżļŖö Ļ▓āņØ┤ļŗż. ņØ┤ļĪĀņĀüņ£╝ļĪ£, ņØ┤Ļ▓āņØ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśļź╝ ņØ╝ņ£╝ĒéżĻ▓ī ļÉ£ļŗż[25].
Cascade hypothesis
Changes in brain structure
ļśÉ ļŗżļźĖ Ļ░ĆņäżņØĆ ļģĖĒÖöņä▒ ļé£ņ▓ŁņØ┤ ļćī ĻĄ¼ņĪ░ņŚÉ ļ│ĆĒÖöļź╝ ņØ╝ņ£╝ĒéżĻ│Ā ņ╣śļ¦ż ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗżļŖö Ļ▓āņØ┤ļŗż. ļ¬ćļ¬ć ļŗ©ļ®┤ ņŚ░ĻĄ¼ļōżņŚÉņä£ ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ļģĖņØĖļōżņØś MRIņŚÉņä£ ņØ╝ņ░© ņ▓ŁĻ░ü Ēö╝ņ¦łņØś ļČĆĒö╝ Ļ░Éņåīļź╝ ļ│┤ņśĆĻ│Ā, ņØ┤ļŖö Ļ░ÉņåīļÉ£ ņ▓ŁĻ░ü ņŗĀĒśĖņŚÉ ņØśĒĢ£ ļ¦īņä▒ņĀüņØĖ ņ▓ŁĻ░ü Ēö╝ņ¦ł ĒÖ£ņä▒ĒÖöņØś Ļ░Éņåī ļĢīļ¼ĖņØ╝ Ļ▓āņØ┤ļŗż[26,27]. ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ļćīļČĆĒö╝ Ļ░ÉņåīņŚÉ ļīĆĒĢ£ 126ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ 6.4ļģä Ļ░äņØś ņČöņĀü ņŚ░ĻĄ¼ņŚÉņä£ ņĀĢņāü ņ▓ŁļĀźĻĄ░ņŚÉ ļ╣äĒĢ┤ ļé£ņ▓ŁĻĄ░ņŚÉņä£ ļćīļČĆĒö╝ņØś Ēü░ Ļ░Éņåīņ£©ņØä ļ│┤ņśĆļŗż. ļśÉĒĢ£, ĻĘĖ Ēü¼ĻĖ░ļŖö ņĀĢņāüĻĄ░Ļ│╝ Ļ▓ĮļÅä ņØĖņ¦Ć ņןņĢĀĻĄ░ Ļ░äņØś ļ│┤ņØ┤ļŖö ļćī ņ£äņČĢņ£©ņØś ņ░©ņØ┤ņÖĆ Ļ░ÖņĢśļŗż[28,29].
ļģĖĒÖöņä▒ ļé£ņ▓ŁņØä Ļ░Ćņ¦ä ļģĖņØĖņŚÉņä£ ļćīļČĆĒö╝ņØś Ļ░Éņåīļź╝ ļ│┤ņØ┤ļŖö ļČĆņ£äļŖö ļćī ņĀäņ▓┤ ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņÜ░ņĖĪ ņĖĪļæÉņŚĮņØ┤ļ®░, ņØ┤ ļČĆņ£äļŖö ĻĄ¼ņ¢┤ ņ▓śļ”¼ ļ░Å ĻĖ░ņ¢Ą, Ļ░ÉĻ░üĒåĄĒĢ®, ņ┤łĻĖ░ ņØĖņ¦ĆņןņĢĀ, ņ┤łĻĖ░ ņĢīņĖĀĒĢśņØ┤ļ©Ė ņ╣śļ¦żņŚÉņä£ ņżæņÜöĒĢ£ ļČĆņ£äņØ┤ļŗż[30]. ļö░ļØ╝ņä£ ņ▓ŁĻ░ü ņ▓śļ”¼Ļ│╝ņĀĢņØä ļŗ┤ļŗ╣ĒĢśļŖö ļČĆņ£äņØś ļćīļČĆĒö╝ Ļ░ÉņåīļŖö ņ×Āņ×¼ņĀüņ£╝ļĪ£ ņ╣śļ¦ż ņ£äĒŚś ņ”ØĻ░Ćļź╝ ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŖö ņØĖņ¦Ć Ļ│╝ņĀĢņŚÉ ņśłņāüņ╣ś ļ¬╗ĒĢ£ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŗż. ļćīļŖö ĒÖśĻ▓Į ņ×ÉĻĘ╣Ļ│╝ ĒĢÖņŖĄņŚÉ ļ░śņØæĒĢśņŚ¼ ļ│ĆĒĢĀ ņłś ņ׳ļŖö ļŖźļĀźņØĖ ņŗĀĻ▓ĮĻ░Ćņåīņä▒(neuroplasticity)ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż[31]. ņÜ®ļČłņÜ®ņäżņØś ņØ┤ļĪĀņØ┤ ņ▓ŁĻ░ü ņŗĀĒśĖ ņ▓śļ”¼Ļ│╝ņĀĢņŚÉļÅä ņĀüņÜ®ļÉśļŖöļŹ░ ļōŻĻ│Ā ĻĘĖĻ▓āņØä ņ▓śļ”¼ĒĢśļŖö ļŖźļĀźņØä Ļ│äņåŹ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖņ£╝ļ®┤ ĻĘĖ ļŖźļĀźņØä ņ×āņØä ņłś ņ׳ļŖö Ļ▓āņØ┤ļŗż. ļģĖņØĖļōżņŚÉĻ▓ī ņ▓ŁļĀźņØś ņĢģĒÖöļŖö ņ▓ŁĻ░üĒö╝ņ¦łņØś ĒÜīļ░▒ņ¦ł(white mater)ņØä ņżäņØ┤ļŖöļŹ░ ņØĖĻ│╝ņĀü ņŚŁĒĢĀņØä ĒĢ£ļŗżĻ│Ā ļ│╝ ņłś ņ׳ļŗż[26].
Social isolation
ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢśļź╝ ņäżļ¬ģĒĢśļŖö ļśÉ ļŗżļźĖ Ļ░ĆņäżņØĆ ņé¼ĒÜīņĀü Ļ│Āļ”ĮņØ┤ļŗż. ļģĖĒÖöņä▒ ļé£ņ▓Ł ĒÖśņ×ÉņŚÉņä£ņØś ņØśņé¼ņåīĒåĄņØś ņŗżĒī©ļŖö ņé¼ĒÜīņĀü ĒåĄĒĢ®ņØä ņŗ¼Ļ░üĒĢśĻ▓ī ņĀ£ĒĢ£ĒĢśļ®░, ņØ┤ļ¤░ ņé¼ĒÜīĒÖöņØś Ļ░ÉņåīļŖö ņé¼ĒÜīņĀü Ļ│Āļ”Į, Ļ│ĀļÅģĻ░ÉĻ│╝ ņÜ░ņÜĖņ”ØņØä ņØ╝ņ£╝ĒéżĻ▓ī ļÉ£ļŗż[32-37]. ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņé¼ĒÜīņĀü Ļ│Āļ”ĮņØ┤ ņĀäļ░śņĀü ņØĖņ¦Ć ņłśĒ¢ēņØś ņĀĆĒĢś, ļ╣ĀļźĖ ņØĖņ¦Ć Ļ░Éņåī, ņŗżĒ¢ē ĻĖ░ļŖź ņĀĆĒĢś, ļČĆņĀĢņä▒ ņ”ØĻ░Ć, ņÜ░ņÜĖ ņØĖņ¦ĆņŚÉ ļīĆĒĢ£ ņ£äĒŚśņÜöņåīņØĖ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż[38]. ļśÉĒĢ£, ļČĆņĪ▒ĒĢ£ ņé¼ĒÜīņĀü ļäżĒŖĖņøīĒü¼ ļ░Å ņé¼ĒÜīņĀü ņ¦Ćņ¦ĆņØś Ļ░Éņåī, Ļ│ĀļÅģĻ░ÉņØ┤ Ļ▒┤Ļ░ĢĒĢ£ ņé¼ļ×īņŚÉĻ▓īņä£ ņ╣śļ¦żņØś ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[39]. ņ”ē, ņÜ░ņÜĖņ”ØĻ│╝ ņé¼ĒÜīņĀü Ļ│Āļ”ĮņØĆ ņ▓ŁĻ░ü ņןņĢĀņÖĆ ņØĖņ¦Ć ņןņĢĀ ņé¼ņØ┤ļź╝ ļ¦żĻ░£ĒĢśļŖö ņŚŁĒĢĀņØä ĒĢśļ®░ ņ▓ŁĻ░üņןņĢĀņÖĆ Ļ┤ĆļĀ©ļÉ£ ņØ┤ļ¤¼ĒĢ£ ļ¼ĖņĀ£ļŖö ņ¦üĻ░äņĀæņĀüņ£╝ļĪ£ ņØĖņ¦ĆņןņĢĀļĪ£ ņØ┤ņ¢┤ņ¦ł ņłś ņ׳ļŗż.
Common mechanism; common cause hypothesis
Common mechanism Ļ░ĆņäżņØĆ ļģĖĒÖöņä▒ ļé£ņ▓Ł ĻĘĖ ņ×Éņ▓┤Ļ░Ć ņ╣śļ¦żļź╝ ņØ╝ņ£╝ĒéżļŖö Ļ▓āņØ┤ ņĢäļŗłļØ╝, ņ╣śļ¦żņÖĆ ļģĖĒÖöņä▒ ļé£ņ▓ŁņŚÉ ĻĖ░ņŚ¼ĒĢśļŖö Ļ│ĄĒåĄ ļ®öņ╗żļŗłņ”śņØ┤ ņ׳ļŗżļŖö Ļ▓āņØ┤ļŗż. ņØ┤ Ļ░ĆņäżņŚÉ ļö░ļź┤ļ®┤ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆņןņĢĀļŖö ļćīņØś ļģĖĒÖöĻ│╝ņĀĢņŚÉņä£ Ļ│ĄĒåĄņĀüņØĖ ņŗĀĻ▓ĮĒć┤ĒÖö Ļ│╝ņĀĢņØś Ļ▓░Ļ│╝ļØ╝Ļ│Ā ĒĢĀ ņłś ņ׳ļŗż[21]. ņ”ē, ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢśĻ░Ć ņøÉņØĖĻ┤ĆĻ│äĻ░Ć ņĢäļŗłļØ╝ Ļ│ĄĒåĄņØś ņøÉņØĖņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśĻ│Ā ņä£ļĪ£ ļÅģļ”ĮņĀüņ£╝ļĪ£ ļ░£ņāØĒĢ£ļŗżļŖö Ļ▓āņØ┤ļŗż[25].
Ļ░ĆņäżņŚÉ ļö░ļź┤ļ®┤ Ļ░ÉĻ░üņĀü ņśłļ»╝ĒĢ©(sensory acuity)ņØĆ ļģĖĒÖöĒĢśļŖö ļćīņØś ņāØļ”¼ņĀü ļ¼┤Ļ▓░ņä▒(physiological integrity)ņØä ļ░śņśüĒĢśļŖö ņ¦ĆĒæ£ļØ╝ ĒĢĀ ņłś ņ׳ļŗż[40]. ļģĖĒÖöņä▒ ļé£ņ▓ŁņØś ļ░£ņāØĻ│╝ņĀĢņŚÉņä£ ļŗżņ¢æĒĢ£ ĻĖ░ļŖźņĀüņØ┤Ļ│Ā ĻĄ¼ņĪ░ņĀüņØĖ ļ│ĆĒÖöĻ░Ć ļ¦Éņ┤łņÖĆ ņżæņČö ĻĖ░Ļ┤ĆņŚÉņä£ ļ░£ņāØĒĢśĻ▓ī ļÉ£ļŗż. ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöļŖö ĒśłĻ┤ĆņĪ░ņØś ļ│Ćņä▒, ņ£Āļ¬©ņäĖĒżņÖĆ ņØ╝ņ░© ĻĄ¼ņŗ¼ ņŗĀĻ▓ĮņØś Ļ░Éņåī, ņÖĆņÜ░ĒĢĄ ņŗĀĻ▓ĮņøÉ Ļ░ÉņåīņÖĆ Ļ░ÖņØĆ ņżæņČö ņ▓ŁĻ░ü Ļ▓ĮļĪ£ņØś ļ│ĆĒÖö, ņŗĀĻ▓ĮņĀäļŗ¼ļ¼╝ņ¦ł ļČäļ╣äņØś ļ│ĆĒÖö ļō▒ņØ┤ ņ׳ļŗż[41].
ļģĖĒÖöņä▒ ļé£ņ▓ŁņŚÉņä£ļŖö ļŗżņ¢æĒĢ£ ņĀĢļÅäļĪ£ ļ¦Éņ┤ł ļ░Å ņżæņČö ņ▓ŁĻ░ü Ļ▓ĮļĪ£ņŚÉņä£ ļ│æļ”¼ĒĢÖņĀü ļ│ĆĒÖöĻ░Ć ļ│ĄĒĢ®ņĀüņ£╝ļĪ£ ņØ╝ņ¢┤ļéśĻ▓ī ļÉ£ļŗż. ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņ╣śļ¦żļŖö ļ│ĄĒĢ®ņĀüņØĖ ņøÉņØĖņ£╝ļĪ£ ļ░£ņāØĒĢśļ®░ Ļ░Ćņן ĒØöĒĢ£ ņøÉņØĖņ£╝ļĪ£ ļ»ĖņäĖņł£ĒÖś ļČĆņĀä, ņĀäņŗĀņĀüņØĖ ņŗĀņ▓┤Ļ▒┤Ļ░ĢņāüĒā£, ņ£ĀņĀä, ņé░ĒÖö ņŖżĒŖĖļĀłņŖż ļō▒ņØ┤ ņ׳ļŗż.
ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖśĻ│╝ ļćīĒśłĻ┤Ć ņ¦łĒÖśņØĆ ņ╣śļ¦żņØś ņ£äĒŚśņÜöņØĖņ£╝ļĪ£ ņל ņĢīļĀżņĀĖ ņ׳ļŗż[6,42]. ļćīņĪĖņ”ØĻ│╝ ļćīĻ▓Įņāē ļō▒ņØś ļćīĒśłĻ┤Ć ņåÉņāüņØĆ ĒśłĻ┤Ćņä▒ ņ╣śļ¦żļź╝ ņØ╝ņ£╝Ēé¼ ļ┐É ņĢäļŗłļØ╝ ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æņØä Ļ░Ćņ¦ä ļģĖņØĖļōżņŚÉĻ▓ī ļŹö ņ×ÉņŻ╝ ļ░£ņāØĒĢ£ļŗż. Ļ▓īļŗżĻ░Ć, ņØĖĻĄ¼ĻĖ░ļ░ś ņĪ░ņé¼ņŚÉņä£ ņżæļō▒ļÅä ļ░Å Ļ│ĀļÅä ļé£ņ▓ŁĻ│╝ ļćīņĪĖņ”Ø ņé¼ņØ┤ņØś ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ļģĖņØĖņĖĄņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŗż[43]. ļīĆļćīņØś ļ»ĖņäĖĒśłĻ┤Ć ņ¦łĒÖśņØ┤ ļćīņŚÉ ļīĆĒĢ£ ĒśłņĢĪ Ļ│ĄĻĖē Ļ░ÉņåīņÖĆ ņé░ņåī, ĒżļÅäļŗ╣, ĻĘĖļ”¼Ļ│Ā ļŗżļźĖ ņśüņ¢æņåīņØś ļČĆņĀüņĀłĒĢ£ Ļ│ĄĻĖēņØä ĒåĄĒĢ┤ ņØĖņ¦Ć ĻĖ░ļŖźņØä ņĀĆĒĢśņŗ£ĒéżĻ│Ā ņŗ¼ņ¦Ćņ¢┤ ņ╣śļ¦ż ļ░£ļŗ¼ņŚÉ ĻĖ░ņŚ¼ĒĢĀ ņłś ņ׳ļŖö Ļ▓āņ▓śļ¤╝[44,45], ļ»ĖņäĖ ĒśłĻ┤Ć ņ¦łĒÖśņØĆ ļé┤ņØ┤ņŚÉļÅä ĒŚłĒśłņä▒ ņåÉņāüņØä ņØ╝ņ£╝ņ╝£ņä£ ņÖĆņÜ░ņØś ĒśłņĢĪ ņł£ĒÖś ļČĆņĀäņØä ņĢ╝ĻĖ░ĒĢĀ ņłś ņ׳ļŗż[46]. ļö░ļØ╝ņä£ ļÅÖļ¦źĻ▓ĮĒÖö, ĒØĪņŚ░, ļŗ╣ļć©ņÖĆ Ļ░ÖņØĆ ĒśłĻ┤Ćņ¦łĒÖśņØś ņ£äĒŚśņÜöņØĖņØ┤ ņ▓ŁļĀźĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ļæś ļŗżņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗżĻ│Ā ĒĢĀ ņłś ņ׳ļŗż[6,20,47,48]. Apolipoprotein E(APOE)ļŖö Ēć┤Ē¢ēņä▒ ņŗĀĻ▓Įņ¦łĒÖśĻ│╝ Ļ░ĢĒĢśĻ▓ī ņŚ░Ļ┤ĆļÉśļŖö ņ£ĀņĀäņ×ÉļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖöļŹ░, ņĢīņĖĀĒĢśņØ┤ļ©Ė ņ╣śļ¦żļź╝ ņ£Āļ░£ĒĢśĻĖ░ ņē¼ņÜ┤ APOE╬Ą4 alleleņØĆ ļśÉĒĢ£ ļé£ņ▓ŁĻ│╝ļÅä ņŚ░Ļ┤ĆļÉ©ņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[49-51]. ņ”ē, 85ņäĖņØś Ļ│ĀļĀ╣ĒÖśņ×ÉļōżņŚÉņä£ APOE╬Ą4 alleleņØä Ļ░Ćņ¦ä Ļ▓ĮņÜ░ ļé£ņ▓ŁņØś ņ£äĒŚśļÅäĻ░Ć 2ļ░░ ņØ┤ņāü ņ”ØĻ░ĆĒ¢łļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż[49].
ļćīļŖö ļŗżņ¢æĒĢ£ ņŗĀĒśĖņĀäļŗ¼ ņŚŁĒĢĀņØä ņłśĒ¢ēĒĢśĻĖ░ ņ£äĒĢ┤ ĒÖöĒĢÖņĀüņ£╝ļĪ£ ļŗżņ¢æĒĢ£ ļ░śņØæĻĖ░ņĀäņØä Ļ░Ćņ¦ĆĻĖ░ ļĢīļ¼ĖņŚÉ ņé░ĒÖöņĀü ņŖżĒŖĖļĀłņŖżņŚÉ ļ»╝Ļ░ÉĒĢśļŗż[52]. ļśÉĒĢ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ ļ░ØĒśĆņ¦ä ļ░öņÖĆ Ļ░ÖņØ┤, ĒÖ£ņä▒ ņé░ņåīĻ░Ć ņ▓ŁĻ░ü ņ▓śļ”¼Ļ│╝ņĀĢņŚÉņä£ ļ»ĖņäĖņł£ĒÖśņŚÉ ņ׳ņ¢┤ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļ®░, ļ»ĖĒåĀņĮśĒŖĖļ”¼ņĢä DNA Ļ▓░ņåÉĻ│╝ ņØ┤ņ¢┤ņ¦ĆļŖö ņäĖĒż ņé¼ļ®ĖĻ│╝ņĀĢņØ┤ ļé┤ņØ┤ņÖĆ ņżæņČö ņ▓ŁĻ░ü Ļ▓ĮļĪ£ņØś ļ│æĒā£ņāØļ”¼ņŚÉ ņ׳ņ¢┤ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢ£ļŗżĻ│Ā ĒĢĀ ņłś ņ׳ļŗż[41,53-55].
Overdiagnosis or harbinger hypothesis
ļé£ņ▓ŁĻ│╝ ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢś ņé¼ņØ┤ņØś ņŚ░Ļ┤Ćņä▒ņØä ņäżļ¬ģĒĢśļŖö ļśÉ ļŗżļźĖ Ļ░ĆļŖźĒĢ£ ļ®öņ╗żļŗłņ”śņØĆ Ļ│╝ņ×ē ņ¦äļŗ©(overdiagnosis)ņØ┤ļ®░, ņØĖņ¦ĆĻĖ░ļŖź ļ│┤ļŗżļŖö ņ▓ŁļĀź Ļ░ÉņåīĻ░Ć ĒŖ╣ņĀĢ ņŗĀĻ▓Įņŗ¼ļ”¼ĒĢÖņĀü Ļ▓Ćņé¼ ņłśĒ¢ēņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ļ▓ĮņÜ░ņØ┤ļŗż. ņ▓ŁļĀź Ļ░ÉņåīĻ░Ć ņØĖņ¦ĆĻĖ░ļŖź ņןņĢĀņØś ņĀĢļÅäļź╝ Ļ│╝ļīĆĒÅēĻ░Ć ĒĢĀ ņłś ņ׳ļŗżļŖö ņČĢņĀüļÉ£ ņ”ØĻ▒░ļōżņØ┤ ņ׳ļŗż[56,57]. ņ▓ŁļĀźņŚÉ ņØśņĪ┤ĒĢśļŖö ņ¢Ėņ¢┤ņĀü ņ¦Ćņŗ£ļéś Ļ│╝ņĀ£Ļ░Ć ņØĖņ¦Ć ĻĖ░ļŖź ĒÅēĻ░Ć ļÅÖņĢł ņé¼ņÜ®ļÉśĻĖ░ ļĢīļ¼ĖņŚÉ, ņ▓ŁļĀźņĀĆĒĢśĻ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉ ļČłļ”¼ĒĢśĻ▓ī ņ×æņÜ®ĒĢśĻ▓ī ļÉ£ļŗż. ņ¢Ėņ¢┤ļŖźļĀźņØä ļ¦ÄņØ┤ ņÜöĒĢśļŖö ņØĖņ¦Ć ĻĖ░ļŖź Ļ▓Ćņé¼ņØś ņäĀĒāØņØĆ ļé£ņ▓ŁņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉ ņĀüņĀłĒĢśņ¦Ć ņĢŖņ¦Ćļ¦ī, ļ╣äņ¢Ėņ¢┤ņĀüņ£╝ļĪ£ ņĖĪņĀĢĒĢśļŖö Ļ▓Ćņé¼ņØ╝ņ¦ĆļØ╝ļÅä ņ▓ŁĻ░üņןņĢĀĻ░Ć ņ׳ņ£╝ļ®┤ Ļ▓Ćņé¼ņŚÉ ļīĆĒĢ£ ņ¦Ćņ╣©ņØ┤ ļ│Ąņ×ĪĒĢ┤ņä£ ņØĖņŗØĒĢśĻĖ░ ņ¢┤ļĀżņÜĖ ņłś ņ׳ļŗż. ļé£ņ▓ŁņØĆ ņ¢┤ļŖÉņĀĢļÅä ņŗĀĻ▓Įņŗ¼ļ”¼ĒĢÖņĀü ĒÅēĻ░ĆņŚÉ ņ׳ņ¢┤ ĻĖ░ļŖźņĀüņ£╝ļĪ£ Ļ▓Ćņé¼ ņłśĒ¢ēņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŗż[58]. ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ļé£ņ▓ŁņØ┤ Ļ░äņØ┤ņĀĢņŗĀņāüĒā£Ļ▓Ćņé¼(Mini-Mental State Examination, MMSE)ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ┤ ņØĖņ¦ĆĻĖ░ļŖźņØ┤ ņĀĢņāüņØĖ ņĀŖņØĆ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŚ░ĻĄ¼ĒĢśņśĆĻ│Ā, Ļ░ÉņåīļÉ£ ņ▓ŁļĀźņØ┤ MMSE ņłśĒ¢ēņŚÉ ņ£ĀņØśĒĢśĻ▓ī ņśüĒ¢źņØä ļ»Ėņ╣śĻ│Ā, ļö░ļØ╝ņä£ ļé£ņ▓ŁņØś ņĀĢļÅäĻ░Ć ņ╣śļ¦ż ņ¦äļŗ©ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ņØīņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż[57]. ņ▓ŁļĀź ņןņĢĀĻ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉ ņØĖņ¦Ć ĻĖ░ļŖźņØ┤ ņĀĢņāüņ×äņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, ņØĖņ¦ĆĻĖ░ļŖź ņןņĢĀļĪ£ Ļ│╝ņ¦äļŗ© ļÉśĻ▒░ļéś ņśżņ¦äļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ņ׳ņØä ņłś ņ׳ļŗż.
ļŗżļźĖ ĒĢ£ĒÄĖņ£╝ļĪ£ļŖö, ņżæņČöņ▓ŁĻ░üņ▓śļ”¼ ņןņĢĀļĪ£ ņØĖĒĢ£ ņ▓ŁļĀźņĀĆĒĢśļŖö ņ”ØņāüņØ┤ ļéśĒāĆļéśĻĖ░ ņĀäņØś ņĢīņĖĀĒĢśņØ┤ļ©Ė ņ╣śļ¦żņØś ņĀäņĪ░(harbinger)ļĪ£ ņŚ¼Ļ▓©ņ¦ł ņłś ņ׳ļŗż[59-61]. ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ņŚÉņä£ ļ¦Éņ┤łņÖĆ ņżæņČö ņ▓ŁĻ░ü ņŗ£ņŖżĒģ£ņØś ĻĖ░ļŖźņĀĆĒĢśĻ░Ć ņĢīņĖĀĒĢśņØ┤ļ©Ė ņ╣śļ¦żņØś ņĀäļŗ©Ļ│äļéś ņ┤łĻĖ░ļŗ©Ļ│äņŚÉņä£ ļéśĒāĆļé£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż. ņżæņČö ņ▓ŁĻ░ü ĻĖ░ļŖźņĀĆĒĢśļĪ£ ļéśĒāĆļéśļŖö ņ▓ŁļĀźņĀĆĒĢśļź╝ ņ¢æļČä ņ▓ŁņĘ© Ļ│╝ņĀ£(dichotic listening task)ļź╝ ĒåĄĒĢ┤ ĒÅēĻ░ĆĒĢśļŖöļŹ░, ņØ┤ļŖö ņĢīņĖĀĒĢśņØ┤ļ©Ė ņ╣śļ¦żņØś ņĀäņĪ░(harbinger)Ļ░Ć ļÉ£ļŗż. ņ┤łĻĖ░ ļŗ©Ļ│äņØś ņØĖņ¦ĆĻĖ░ļŖźņĀĆĒĢśļŖö ļé£ņ▓Łņ£╝ļĪ£ ņŚ¼Ļ▓©ņ¦ĆļŖö ņ”Øņāü ļÆżņŚÉ ņł©Ļ▓©ņ¦ł ņłś ņ׳ļŗż. ļö░ļØ╝ņä£, ļé£ņ▓ŁņŚÉ ļīĆĒĢ£ ņŖżĒü¼ļ”¼ļŗØ, ĒŖ╣Ē׳ ņ£äĒŚśņØ┤ ņ׳ļŖö ĻĄ░ņŚÉņä£ ņżæņČö ņ▓ŁĻ░ü ĒģīņŖżĒŖĖļŖö ņĢīņĖĀĒĢśņØ┤ļ©Ė ņ╣śļ¦żņØś ņĀäĻĄ¼ļŗ©Ļ│äļź╝ ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŖö ņĀĆļĀ┤ĒĢśĻ│Ā ĒÜ©Ļ│╝ņĀüņØĖ ņłśļŗ©ņ£╝ļĪ£ ņČöņ▓£ļÉ£ļŗż[61,62].
New conceptual model of frailty
ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ņé¼ņØ┤ņØś ņŚ░Ļ┤Ćņä▒ņØä ņäżļ¬ģĒĢśĻĖ░ ņ£äĒĢ┤ ņĄ£ĻĘ╝ ļģĖņćĀ(frailty)ņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ░ĆņäżņØ┤ ņĀ£ĻĖ░ļÉśĻ│Ā ņ׳ļŗż[63,64]. Frailtyļ×Ć ļŗżņØīņØś 3Ļ░Ćņ¦Ć ņØ┤ņāüņØś ņ”Øņāü(ņØśļÅäņ╣ś ņĢŖņØĆ ņ▓┤ņżæ Ļ░Éņåī, Ēāłņ¦ä, ļ¼┤ļĀźĻ░É, ļŖÉļ”░ Ļ▒ĖņØī ņåŹļÅä, ļé«ņØĆ ņŗĀņ▓┤ ĒÖ£ļÅÖ)ņØä ļÅÖļ░śĒĢśļŖö ņ×äņāüņĀü ņ”ØĒøäĻĄ░ņØä ļ¦ÉĒĢ£ļŗż[65]. ļśÉĒĢ£ frailtyļŖö ļéÖņāü, ņןņĢĀ, ņ×”ņØĆ ņ×ģņøÉ, ņÜöņ¢æņŗ£ņäżņ×ģņåī, ņé¼ļ¦Ø ļō▒ņØś ņ£äĒŚśņØä ļåÆņØĖļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż[64]. Ļ▓īļŗżĻ░Ć ņĄ£ĻĘ╝ņØś ņØĖĻĄ¼ĻĖ░ļ░ś ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļģĖĒÖöņä▒ ļé£ņ▓ŁņØ┤ frailty ļ░£ņāØ ņ£äĒŚśņØä ļåÆņØĖļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż[66]. ļé£ņ▓ŁņØ┤ ņ׳ļŖö ļģĖņØĖņØś Ļ▓ĮņÜ░, frailtyņØś ļ░£ņāØ ņ£äĒŚśņØ┤ 63%Ļ╣īņ¦Ć ņ”ØĻ░ĆĒĢśĻ│Ā ļģĖĒÖöņä▒ ļé£ņ▓ŁņØ┤ ļéÖņāüņØś ļåÆņØĆ ņ£äĒŚśĻ│╝ Ļ┤ĆļĀ©ļÉśļŖö frailtyņØś ļÅģļ”ĮņĀüņØĖ ņ£äĒŚś ņÜöņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢ©ņØä ļ│┤ņŚ¼ņŻ╝Ļ│Ā ņ׳ļŗż[67]. Ļ▓īļŗżĻ░Ć ļģĖĒÖöņä▒ ļé£ņ▓ŁņØ┤ ņŗĀņ▓┤ ĒÖ£ļÅÖ ļ░Å ļŖÉļ”░ Ļ▒ĖņØī ņåŹļÅäņÖĆ ļéÖņāü ļō▒Ļ│╝ Ļ░ÖņØĆ frailtyņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ▒┤Ļ░Ģ ņÜöņåīņÖĆ Ļ┤ĆļĀ©ļÉ©ņØ┤ ļ│┤Ļ│Ā ļÉśņŚłļŗż[68,69]. ĻĘĖļ”¼Ļ│Ā, frailtyļŖö ņØĖņ¦ĆĻĖ░ļŖź ņןņĢĀ ļ░Å ņ╣śļ¦żņÖĆļÅä Ļ┤ĆļĀ©ļÉ©ņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[70-72]. ļö░ļØ╝ņä£, ļģĖĒÖöņä▒ ļé£ņ▓ŁņØĆ frailtyņØś ņżæņÜöĒĢ£ ņ¦ĆĒæ£Ļ░Ć ļÉśļ®░, frailty ņ×Éņ▓┤Ļ░Ć ņ¦üņĀæņĀüņ£╝ļĪ£ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś Ļ▓░ņĀĢņÜöņåīĻ░Ć ļÉśĻĖ░ļÅä ĒĢśĻ│Ā, ņØśņé¼ņåīĒåĄ ņĀĆĒĢś ļ░Å ĻĘĖņŚÉ ļö░ļź┤ļŖö ņé¼ĒÜīņĀü Ļ│Āļ”ĮĻ│╝ ņÖĖļĪ£ņøĆ, ĻĘĖļ”¼Ļ│Ā ņÜ░ņÜĖņ”ØĻ│╝ Ļ░ÖņØĆ ļČĆņłśņĀüņØĖ ņÜöņåīļōżņØä ĒåĄĒĢ┤ Ļ░äņĀæņĀüņ£╝ļĪ£ Ļ▓░ņĀĢ ņÜöņØĖņØ┤ ļÉśĻĖ░ļÅä ĒĢ£ļŗż(Fig. 2) [73].
ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņé¼ĒÜīņĀü Ļ│Āļ”ĮņØĆ ļåÆņØĆ ņŚ░Ļ┤Ćņä▒ņØä Ļ░Ćņ¦Ćļ®░, ĻĘĖ ņŚ░Ļ┤Ćņä▒ņØĆ ļé©ņ×Éļ│┤ļŗżļŖö ņŚ¼ņ×ÉņŚÉĻ▓īņä£ ļŹö ļåÆĻ▓ī ļéśĒāĆļé£ļŗż[74]. ļģĖĒÖöņä▒ ļé£ņ▓ŁņØĆ ņÜ░ņÜĖņ”Ø, ļČłņĢł, ņŖżĒŖĖļĀłņŖż ļō▒Ļ│╝ļÅä ļ░ĆņĀæĒ׳ Ļ┤ĆļĀ©ļÉ£ļŗż[75]. ĻĘĖļ”¼Ļ│Ā ņÜ░ņÜĖņ”ØņØ┤ ņ╣śļ¦żļéś ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æņØś ņ┤łĻĖ░ ņ¦ĢĒøäļĪ£ ņŚ¼Ļ▓©ņ¦ĆĻĖ░ļÅä ĒĢ£ļŗż[76]. ļśÉĒĢ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņŚÉņä£ ņÜ░ņÜĖņ”ØņØ┤ ļģĖĒÖö Ļ│╝ņĀĢņØä Ļ░ĆņåŹĒÖöņŗ£ņ╝£ņä£ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØ┤ļéś ņØĖņ¦ĆĻĖ░ļŖź ņןņĢĀņÖĆ Ļ░ÖņØĆ ļģĖĒÖöĻ┤ĆļĀ© ņ¦łļ│æņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż[33,77,78]. ņÜ░ņÜĖņ”ØĻ│╝ frailty Ļ░äņØś ņ¢æļ░®Ē¢źņä▒ņØś ņŚ░Ļ┤Ćņä▒ļÅä ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[79].
ņĢ×ņØś ņŚ░ĻĄ¼ļōżņØä ļ░öĒāĢņ£╝ļĪ£ ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś, ļŹö ļéśņĢäĻ░Ć ņ╣śļ¦żņÖĆņØś Ļ┤ĆĻ│äļź╝ ņé¼ĒÜīņĀü Ļ│Āļ”Į, ņÜ░ņÜĖņ”Ø, frailtyņÖĆ Ļ░ÖņØĆ ņżæĻ░ä ļ¦żĻ░£ņ▓┤ļź╝ ĒåĄĒĢ┤ ĒÖĢļ”ĮĒĢ┤ ļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż(Fig. 2). ņ”ē, ļģĖĒÖöņä▒ ļé£ņ▓ŁņØĆ ņÜ░ņÜĖņ”ØĻ│╝ frailtyņØś ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā, ņł£ņ░©ņĀüņ£╝ļĪ£ ņŚ░Ļ┤Ćņä▒ņØä Ļ░¢ļŖö ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņÖĆ ņ╣śļ¦żņØś ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£ĒéżĻ▓ī ļÉ£ļŗż. ļģĖĒÖöņä▒ ļé£ņ▓ŁņØĆ ņØ┤ conceptual modelņŚÉņä£ ņé¼ĒÜīņĀü Ļ│Āļ”Į, ņÜ░ņÜĖņ”Ø, frailty, ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņØś ņØ╝ņ░©ņĀüņØĖ Ļ░£ņäĀ Ļ░ĆļŖźĒĢ£ ņ£äĒŚśņÜöņØĖņØ┤ ļÉśĻĖ░ ļĢīļ¼ĖņŚÉ, ļ│┤ņ▓ŁĻĖ░ņÖĆ Ļ░ÖņØĆ ņ▓ŁĻ░üņĀü ņżæņ×¼Ļ░Ć ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦żņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ▓░Ļ│╝ļź╝ ņāüļŗ╣Ē׳ Ļ░£ņäĀņŗ£Ēé¼ Ļ▓āņØ┤ļØ╝ ņśłņāüļÉ£ļŗż. ĻĘĖļ¤¼ļéś ņØ┤ ļ¬©ļŹĖņØ┤ ļģĖĒÖöņä▒ ļé£ņ▓ŁņØä ņ╣śļŻīĒĢśļŖö Ļ▓āņØ┤ ļģĖņØĖļōżņŚÉĻ▓īņä£ ņØĖņ¦Ć ĻĖ░ļŖź Ē¢źņāüņŚÉ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļØ╝ļŖö ĻĘ╝Ļ▒░ļź╝ ņĀ£Ļ│ĄĒĢśņ¦Ćļ¦ī, ņĢäņ¦üņØĆ ņĀĢĒÖĢĒĢ£ ņØĖĻ│╝Ļ┤ĆĻ│äņØś ĒÖĢļ”ĮņØä ņ£äĒĢ┤ ļ¦ÄņØĆ ĒøäņåŹ ņŚ░ĻĄ¼ļōżņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
ņØĖņ¦ĆĻĖ░ļŖź Ļ░£ņäĀņØä ņ£äĒĢ£ ļ│┤ņ▓ŁĻĖ░ ļ░Å ņØĖĻ│ĄņÖĆņÜ░ņØś ĒÜ©Ļ│╝
ļ│┤ņ▓ŁĻĖ░ļéś ņØĖĻ│ĄņÖĆņÜ░Ļ░Ć ņ▓ŁļĀźņØ┤ ņåÉņāüļÉ£ ļģĖņØĖļōżņŚÉĻ▓ī ņØĖņ¦ĆĻĖ░ļŖźņØä Ē¢źņāü ņŗ£ĒéżļŖöļŹ░ ĻĖ░ņŚ¼ĒĢĀ Ļ▓āņØĖĻ░ĆņŚÉ ļīĆĒĢ£ ņØśļ¼ĖņØĆ ņśżļלņĀäļČĆĒä░ ņĀ£ĻĖ░ļÉśņŚłļ¦ī, ņØ┤ļź╝ ņ”Øļ¬ģĒĢśĻĖ░ļŖö ņēĮņ¦Ć ņĢŖļŗż. ļ│┤ņ▓ŁĻĖ░ Ļ░ÖņØĆ ņ▓ŁĻ░üņĀü ņżæņ×¼Ļ░Ć ņØĖņ¦ĆĻĖ░ļŖźņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņ×ģņ”ØĒĢśļŖö ņ”ØĻ▒░ļŖö ņĀ£ĒĢ£ņĀüņØ┤Ļ│Ā ņØ╝Ļ┤Ćņä▒ņØ┤ ņŚåĻĖ░ ļĢīļ¼ĖņŚÉ ņĢ×ņ£╝ļĪ£ ņØ┤ ļ¼ĖņĀ£ļź╝ ĒĢ┤Ļ▓░ĒĢśĻĖ░ ņ£äĒĢ┤ ĒøäņåŹ ņŚ░ĻĄ¼ļōżņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż.
ļ│┤ņ▓ŁĻĖ░Ļ░Ć ņØĖņ¦Ć ĻĖ░ļŖźņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ┤ ļ¼┤ņ×æņ£äļīĆņĪ░ņŗ£ĒŚś(randomized controlled trial)ņØä ņłśĒ¢ēĒĢ£ ļ¬ć Ļ░Ćņ¦Ć ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ļŗż. Mulrow ļō▒[80]ņØĆ 4Ļ░£ņøöĻ░ä 188ļ¬ģņØś ļé£ņ▓ŁĒÖśņ×ÉļōżņØä ļ│┤ņ▓ŁĻĖ░ ņ░®ņÜ®ĻĄ░Ļ│╝ ļ»Ėņ░®ņÜ®ĻĄ░ņ£╝ļĪ£ ļéśļłĀņä£ ņŚ░ĻĄ¼Ē¢łĻ│Ā, ļ│┤ņ▓ŁĻĖ░ļź╝ ņ░®ņÜ®ĒĢ£ ĻĄ░ņŚÉņä£ ņ×æņ¦Ćļ¦ī ņ£ĀņØśĒĢ£ ņØĖņ¦Ć ļŖźļĀźņØś Ē¢źņāüņØä ļ│┤Ļ│ĀĒ¢łļŗż. ĻĘĖļ¤¼ļéś, ļ│┤ņ▓ŁĻĖ░ņØś ņØĖņ¦ĆĻĖ░ļŖź Ē¢źņāüņØś ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ ļŗżĻĖ░Ļ┤Ć ņØ┤ņżæ ļ¦╣Ļ▓ĆĻ▓Ćņé¼Ļ░Ć 65ņäĖ ņØ┤ņāü ņĢīņĖĀĒĢśņØ┤ļ©Ė ņ╣śļ¦żĒÖśņ×É 51ļ¬ģņŚÉņä£ ņłśĒ¢ēļÉśņŚłĻ│Ā, 6Ļ░£ņøöĒøä ņĢīņĖĀĒĢśņØ┤ļ©Ėļ│æ ĒÅēĻ░Ćņ▓ÖļÅä(AlzheimerŌĆÖs disease assessment scale-cognitive subscale)ņŚÉņä£ ļ│┤ņ▓ŁĻĖ░ ņ░®ņÜ® ĒøäņŚÉļÅä ņ£ĀņØśĒĢ£ ļ│ĆĒÖöļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņØīņØ┤ ļ│┤Ļ│ĀļÉśĻĖ░ļÅä ĒĢśņśĆļŗż[81].
Ēöäļ×æņŖżņŚÉņä£ 10Ļ░£ņØś 3ņ░© ņØśļŻīĻĖ░Ļ┤ĆņŚÉņä£ ņłśĒ¢ēĒĢ£ ņĀäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ 65ņäĖņŚÉņä£ 85ņäĖņØś 94ļ¬ģ ĒÖśņ×ÉņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀ ņĀä, ņłśņłĀ Ēøä 6Ļ░£ņøö, 12Ļ░£ņøö Ēøä ņØĖņ¦ĆĻĖ░ļŖźņØä ĒÅēĻ░ĆĒĢśņśĆļŗż[82]. ņłśņłĀ ņĀä ļé«ņØĆ ņØĖņ¦Ć ĻĖ░ļŖź ņĀÉņłśļź╝ ļ░øņØĆ ĒÖśņ×ÉļōżņØś 80% ņØ┤ņāüņŚÉņä£ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀ Ēøä 12Ļ░£ņøöņ¦Ė ņØĖņ¦Ć ĻĖ░ļŖźņØś Ē¢źņāüņØä ļ│┤ņśĆĻ│Ā ņØĖĻ│ĄņÖĆņÜ░ļź╝ ĒåĄĒĢ£ ņ▓ŁĻ░üņĀü ņ×¼ĒÖ£ņØ┤ ļģĖņØĖļōżņŚÉĻ▓ī ņåÉņāüļÉ£ ņØĖņ¦ĆĻĖ░ļŖźņØś Ļ░£ņäĀĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗżļŖö Ļ▓░ļĪĀņØä ļé┤ņŚłļŗż. ņĄ£ĻĘ╝ņØś ļśÉ ļŗżļźĖ ņŚ░ĻĄ¼ļŖö ļ│┤ņ▓ŁĻĖ░ņÖĆ ņØĖĻ│ĄņÖĆņÜ░Ļ░Ć ņĀĢņŗĀ Ļ▒┤Ļ░ĢņĖĪļ®┤ņŚÉņä£ņØś ņéČņØś ņ¦łņØä Ē¢źņāüņŗ£Ēé©ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż[83]. ĒŖ╣Ē׳ ņØĖĻ│ĄņÖĆņÜ░Ļ░Ć ļ│┤ņ▓ŁĻĖ░ņŚÉ ļ╣äĒĢ┤ 6Ļ░£ņøö, 12Ļ░£ņøö ņ¦Ė ņé¼ņÜ® Ēøä 2ļ░░ļéś ņĀĢņŗĀņĀü ņĖĪļ®┤ņØś ņĀÉņłśļź╝ Ē¢źņāüņŗ£ņ╝░ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż. Di Nardo ļō▒[84]ņØĆ 60ņäĖ ņØ┤ņĀäņŚÉ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņŗ£Ē¢ēĒĢ£ ĒÖśņ×ÉņÖĆ 60ņäĖ ņØ┤ņāü ĒÖśņ×Éļōż Ļ░äņØś ņ▓ŁĻ░ü ņłśĒ¢ēļĀźĻ│╝ ļ¬ć Ļ░Ćņ¦Ć ņéČņØś ņ¦ł Ļ▓░Ļ│╝ļź╝ ļ╣äĻĄÉĒ¢łļŗż. 60ņäĖ ņØ┤ņĀäņŚÉ ņØĖĻ│ĄņÖĆņÜ░ļź╝ ņŗ£Ē¢ē ļ░øņØĆ ĒÖśņ×ÉļōżņØ┤ ņ¢Ėņ¢┤ĒÅēĻ░ĆņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ņÜ░ņłśĒ¢łņ¦Ćļ¦ī, Ļ│ĀļĀ╣ņØś ņØĖĻ│ĄņÖĆņÜ░ ĒÖśņ×ÉļōżļÅä ņłśņłĀ ņĀäņŚÉ ļ╣äĒĢ┤ ņ¢Ėņ¢┤ ĒÅēĻ░ĆņŚÉņä£ ņ£ĀņØśĒĢ£ Ē¢źņāüņØä ļ│┤ņśĆļŗż. ļśÉĒĢ£ ņŗĀņ▓┤ņĀü ļ░Å ņĀĢņŗĀņĀü Ļ▒┤Ļ░Ģ ņ▓ÖļÅä, ņÖĖļČĆņØĖĻ│╝ ļīĆĒÖö, TVļéś ņĀäĒÖöņØś ņé¼ņÜ® ļō▒ņŚÉņä£ ņĀĢņāüņØĖļōżĻ│╝ļÅä ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ĒØźļ»ĖļĪ£ņÜ┤ Ļ▓āņØĆ ņØĖĻ│ĄņÖĆņÜ░ ņłśņłĀņŚÉņä£ņØś ņĀäļ░śņĀü ļ¦īņĪ▒ļÅäļŖö ņĀŖņØĆ ņŚ░ļĀ╣ņŚÉ ļ╣äĒĢ┤ Ļ│ĀļĀ╣ĒÖśņ×ÉļōżņŚÉņä£ ļŹö ļåÆņĢśļŗż. Ļ│ĀļĀ╣ ņØĖĻ│ĄņÖĆņÜ░ ĒÖśņ×ÉļōżņŚÉņä£ ņØ┤ļ¤░ ļåÆņØĆ ļ¦īņĪ▒ļÅäņÖĆ ņéČņØś ņ¦łĻ│╝ ņØśņé¼ņåīĒåĄ ļŖźļĀźņØś ĻĘ╣ņĀüņØĖ Ē¢źņāüņØĆ ņ▓ŁĻ░ü ņØĖņŗØņØś Ē¢źņāüļ¦īņ£╝ļĪ£ļŖö ņäżļ¬ģĒĢĀ ņłśļŖö ņŚåļŗż. ļö░ļØ╝ņä£ ņØĖĻ│Ą ņÖĆņÜ░ļź╝ ņØ┤ņÜ®ĒĢ£ ņ▓ŁĻ░üņĀü ņ×¼ĒÖ£Ļ│╝ ņØĖņ¦ĆĻĖ░ļŖź Ē¢źņāüĻ│╝ņØś Ļ┤ĆĻ│äļź╝ ņ×ģņ”ØĒĢśĻĖ░ ņ£äĒĢ£ ļŹö ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż.
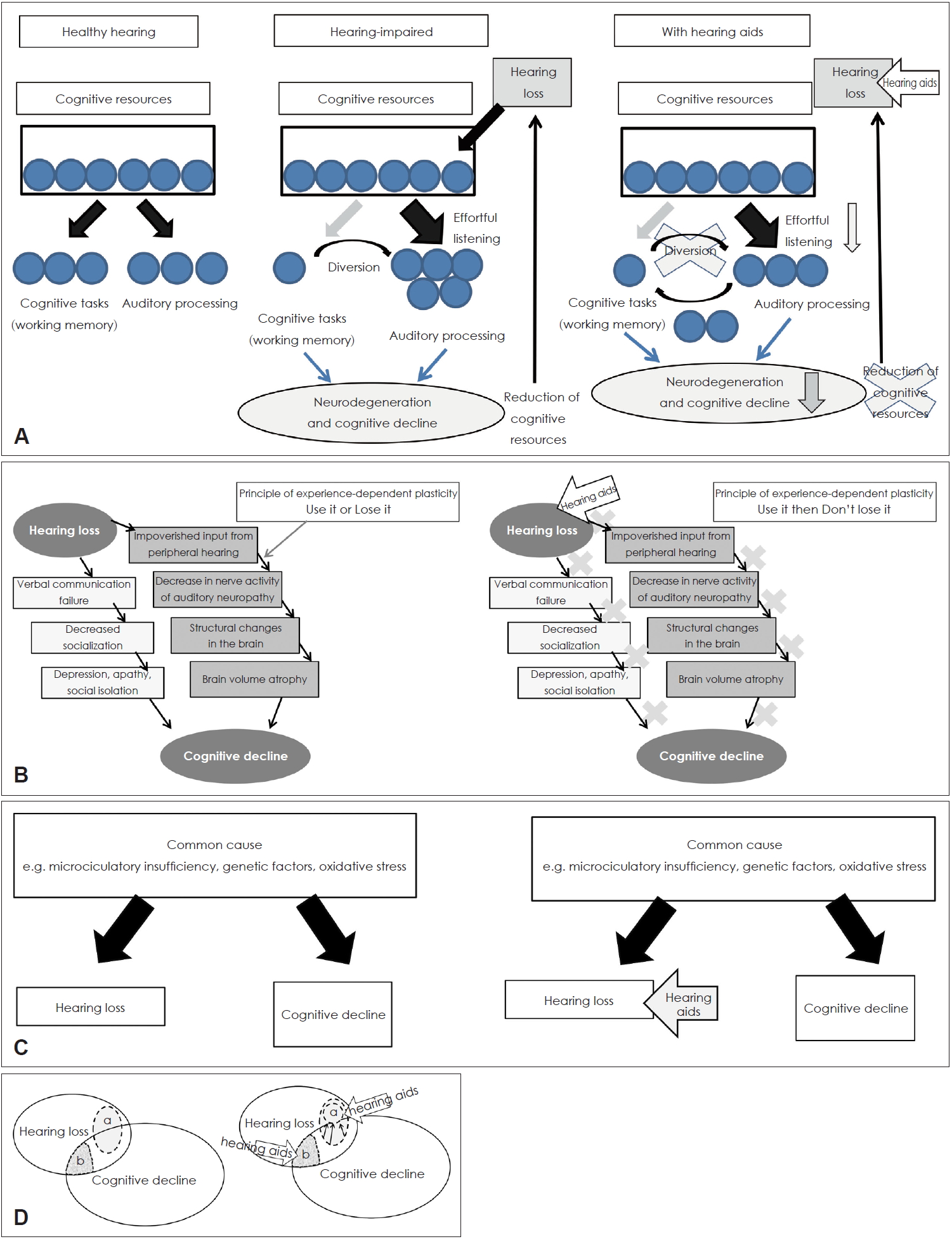
ņØ┤ņĀäņØś ņŚ░ĻĄ¼Ļ▓░Ļ│╝ļōżņØĆ ņØ╝Ļ┤ĆļÉśņ¦Ć ņĢŖņĢśĻ│Ā ļ¦ÄņØĆ ņŚŁĒĢÖņĀü ņŚ░ĻĄ¼ļōżņØ┤ ņ▓ŁļĀźņןņĢĀĻ░Ć ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśņÖĆ ļ░ĆņĀæĒĢśĻ▓ī ņŚ░Ļ┤ĆļÉ©ņØä ļ│┤ņŚ¼ņŻ╝ņŚłņ¦Ćļ¦ī ļ│┤ņ▓ŁĻĖ░ ņé¼ņÜ®ņØ┤ ņÖ£ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśļź╝ ņśłļ░®ĒĢĀ ņłś ņ׳ņØäņ¦ĆņŚÉ ļīĆĒĢ┤ ļģ╝ļ”¼ņĀüņ£╝ļĪ£ ņ”Øļ¬ģĒĢśļŖö Ļ▓āņØĆ ņĢäņ¦ü ņ¢┤ļĀĄĻ│Ā ļ¬ģĒÖĢĒĢśņ¦Ć ņĢŖļŗż. ņĢ×ņŚÉņä£ ņé┤ĒÄ┤ ļ│Ė Ļ░üĻ░üņØś Ļ░ĆņäżņŚÉņä£ ņøÉņØĖ ļ®öņ╗żļŗłņ”śņØä Ļ│ĀļĀżĒĢ┤ņä£ ņ▓ŁĻ░üņĀü ņżæņ×¼Ļ░Ć ņØĖņ¦ĆĻĖ░ļŖź Ē¢źņāüņŚÉ ņ¢┤ļ¢ż ņśüĒ¢źņØä ļ»Ėņ╣Āņ¦ĆņŚÉ ļīĆĒĢ┤ Fig. 3ņŚÉņä£ ļ│╝ ņłś ņ׳ļŗż.
ļ¦īņĢĮ congnitive load hypothesisĻ░Ć ļ¦×ļŗżļ®┤, ļ│┤ņ▓ŁĻĖ░ ņé¼ņÜ®ņØĆ ņ▓ŁĻ░üņ▓śļ”¼Ļ│╝ņĀĢņŚÉņä£ ĒĢäņÜöĒĢ£ ļģĖļĀźņØä ņżäņØ╝ ņłś ņ׳Ļ│Ā, ļČłĒĢäņÜöĒĢ£ ņØĖņ¦Ć ņłśĒ¢ēņ£╝ļĪ£ ņØĖņ¦Ć ņ×ÉņøÉņØä ņĀäĒÖśņŗ£ņ╝£ ļćīņ£äņČĢ Ļ│╝ņĀĢņØä ļ¦ēĻ│Ā ņØĖņ¦Ć ņ×ÉņøÉņØä ņ£Āņ¦Ćņŗ£Ēé¼ ņłś ņ׳ļŗż(Fig. 3A). ļ¦īņĢĮ cascade hypothesisĻ░Ć ņ£ĀĒÜ©ĒĢśļŗżļ®┤, ļ¦Éņ┤łļĪ£ļČĆĒä░ ļōżņ¢┤ņśżļŖö ņ¦ĆņåŹņĀüņØĖ ņ×ģļĀźņØĆ ļ│┤ņ▓ŁĻĖ░ļź╝ ņé¼ņÜ®ĒĢ©ņ£╝ļĪ£ņŹ© ņ£Āņ¦ĆļÉśĻ▓ī ļÉ£ļŗż. Ļ▓ĮĒŚś ņżæņŗ¼ņØś Ļ░Ćņåīņä▒ņŚÉ ņØśĻ▒░ĒĢśļ®┤, ĻĄ¼ņĪ░ņĀüņØ┤Ļ│Ā ĻĖ░ļŖźņĀüņØĖ ļćīņØś ņ×¼ĻĄ¼ņä▒ ļŖźļĀźņØĆ ņä▒ņØĖņØś ņä▒ņłÖĒĢ£ ļćīņØ╝ņ¦ĆļØ╝ļÅä ņÖĖļČĆļéś ļé┤ļČĆ ĒÖśĻ▓Į ļ│ĆĒÖöņŚÉ ņĀüņØæĒĢśĻ▓ī ļÉ£ļŗż[85]. ļ│┤ņ▓ŁĻĖ░ ņé¼ņÜ®ņ£╝ļĪ£ ņØĖĒĢ£ ņØśņé¼ņåīĒåĄ ļŖźļĀźņØś ĒÜīļ│ĄņØ┤ ņé¼ĒÜīņĀü ĻĄÉļźś Ē¢źņāüņØä ļÅĢĻ▓ī ļÉ£ļŗż(Fig. 3B). Ļ░ĢĒĢ£ ņé¼ĒÜīņĀü ņ£ĀļīĆĻ░ÉņØä ņ£Āņ¦Ćņŗ£ĒéżļŖö Ļ▓āņØ┤ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢśļź╝ ļ¦ēĻ│Ā ņ╣śļ¦żņØś ļ░£ņāØņØä ņ¦ĆņŚ░ņŗ£Ēé¼ ņłś ņ׳ļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ļŗż[86]. Hsiao ļō▒[87]ņØĆ ņĢīņĖĀĒĢśņØ┤ļ©Ė ņ╣śļ¦żņØś ļÅÖļ¼╝ ļ¬©ļŹĖņŚÉņä£ ņØĖņ¦Ć Ļ▓░ĒĢŹņŚÉ ņ׳ņ¢┤ ņé¼ĒÜīņĀü ĒÖ£ļÅÖņØś ņżæņÜöņä▒ņØä ņŚ░ĻĄ¼Ē¢łĻ│Ā, ņé¼ĒÜīņĀü Ļ│Āļ”ĮņØ┤ ņØĖņ¦ĆĻĖ░ļŖźņןņĢĀļź╝ Ļ░ĆņåŹĒÖöņŗ£ĒéżĻ│Ā ļÅÖļģäļ░░ļōżĻ│╝ņØś ņé¼ĒÜīņĀü ĻĄÉļźśĻ░Ć ņĢīņĖĀĒĢśņØ┤ļ©Ė ņ╣śļ¦ż Ļ┤ĆļĀ© ĻĖ░ņ¢ĄļĀź ņןņĢĀļź╝ ņ¢┤ļ¢╗Ļ▓ī ĻĄ¼ņĀ£ĒĢĀ ņłś ņ׳ļŖöņ¦Ćļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ļ¦īņĢĮ common cause hypothesisĻ░Ć ļ¦×ļŗżļ®┤, ņØĖņ¦Ć ĻĖ░ļŖź ņןņĢĀļŖö ņ▓ŁĻ░üņĀü ņżæņ×¼ņÖĆļŖö ņĢäļ¼┤ļ¤░ Ļ┤ĆļĀ©ņŚåņØ┤ ņ¦äĒ¢ēļÉĀ Ļ▓āņØ┤ļŗż. ņ▓ŁĻ░ü ņןņĢĀļź╝ Ļ░Éņåīņŗ£ĒéżļŖöļŹ░ ļ│┤ņ▓ŁĻĖ░Ļ░Ć ļ¦żņÜ░ ĒÜ©Ļ│╝ņĀüņØ╝ņ¦ĆļØ╝ļÅä, ņØĖņ¦ĆņןņĢĀļź╝ ņśłļ░®ĒĢśļŖö ļŹ░ļŖö ĻĖ░ņŚ¼ĒĢśņ¦Ć ļ¬╗ĒĢĀ Ļ▓āņØ┤ļŗż(Fig. 3C). Overdiagnosis hypothesisņŚÉņä£ļŖö ļ│┤ņ▓ŁĻĖ░ ņé¼ņÜ®ņØ┤ ņĀĢĒÖĢĒĢ£ ņŗĀĻ▓Įņŗ¼ļ”¼ĒĢÖ Ļ▓Ćņé¼ ņłśĒ¢ēņØä Ļ░ĆļŖźĒĢśĻ▓ī ĒĢśĻ│Ā Ļ│╝ņ×ēņ¦äļŗ©ņØ┤ļéś ņśżņ¦äņØś Ļ░ĆļŖźņä▒ņØä ņżäņØ╝ ņłś ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż(Fig. 3D). Harbinger hypothesisņŚÉņä£ļŖö ņ▓ŁĻ░üņĀü ņżæņ×¼Ļ░Ć ņ╣śļ¦ż ļ░£ņāØņØä ņ¦ĆņŚ░ņŗ£Ēé¼ ņłś ņ׳ņØä ņ¦ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö ņóĆ ļŹö ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż. ļö░ļØ╝ņä£ ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢśņŚÉ ļīĆĒĢ£ ļ®öņ╗żļŗłņ”śņŚÉ ļö░ļØ╝ņä£ ņ▓ŁĻ░üņĀü ņżæņ×¼Ļ░Ć ņØĖņ¦Ć ĻĖ░ļŖź Ē¢źņāüņŚÉ ļ»Ėņ╣Ā ņśüĒ¢źņØĆ ļŗżņ¢æĒĢ£ ņ¢æņāüņ£╝ļĪ£ ļ│Ąņ×ĪĒĢśĻ▓ī ļéśĒāĆļé£ļŗż.
Ļ▓░ ļĪĀ
ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢśņØś ļåÆņØĆ Ļ┤ĆļĀ©ņä▒ņØĆ ņŚ¼ļ¤¼ ļģ╝ļ¼ĖļōżņØä ĒåĄĒĢ┤ ņĢī ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņØ┤ ļæśņØś Ļ┤ĆĻ│äĻ░Ć ļģĖĒÖöņä▒ ļé£ņ▓ŁņØ┤ ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢśļź╝ ņØ╝ņ£╝ĒéżļŖö ņøÉņØĖņØĖņ¦Ć, ņĢäļŗłļ®┤ Ļ│ĄĒåĄņØś ņøÉņØĖņŚÉ ņØśĒĢ┤ ļģĖĒÖöņä▒ ļé£ņ▓ŁĻ│╝ ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢśĻ░Ć ļÅÖņŗ£ņŚÉ ļ░£ņāØļÉśļŖöņ¦ĆļŖö ņĢäņ¦ü ļģ╝ļ×ĆņØś ņŚ¼ņ¦ĆĻ░Ć ļ¦Äņ¦Ćļ¦ī, ņĢäļ¦łļÅä ļ│ĄĒĢ®ņĀüņØĖ ņÜöņØĖļōżņØ┤ Ļ┤ĆņŚ¼ĒĢśļŖö ņä£ļĪ£ ļåÆņØĆ Ļ┤ĆļĀ©ņä▒ņØä Ļ░¢ļŖö Ļ┤ĆĻ│äņØ╝ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. ļśÉĒĢ£, ļģĖĒÖöņä▒ ļé£ņ▓ŁņØĆ ņØĖņ¦ĆĻĖ░ļŖź ņĀĆĒĢś ļ░Å ņ╣śļ¦żņØś ņżæņÜöĒĢ£ ņ£äĒŚśņÜöņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ, ņ╣śļ¦żņØś ņśłļ░®ņØä ņ£äĒĢ┤ņä£ ļ│┤ņ▓ŁĻĖ░ļéś ņØĖĻ│ĄņÖĆņÜ░ ļō▒ņØä ĒåĄĒĢ£ ņ▓ŁĻ░üņĀü ņ×¼ĒÖ£ņØś ņżæņÜöņä▒ņØ┤ Ļ░ĢņĪ░ļÉśļŖö Ļ▓āņØ┤ļŗż. ļö░ļØ╝ņä£, ņל ļōŻļŖö Ļ▓āņØś ņżæņÜöņä▒ņŚÉ ļīĆĒĢ£ ņé¼ĒÜīņĀü Ļ│äļ¬ĮņØ┤ ĒĢäņÜöĒĢśļ®░, ņØĖņ¦Ć ĻĖ░ļŖź ņĀĆĒĢśņØś ņ£äĒŚśņä▒ ņ׳ļŖö ĒÖśņ×ÉļōżņŚÉĻ▓ī ņ▓ŁļĀź ņŖżĒü¼ļ”¼ļŗØņØś ĒĢäņÜöņä▒ņŚÉ ļīĆĒĢ┤ ņĢīļ”¼ļŖö Ļ▓ā ļśÉĒĢ£ ņżæņÜöĒĢ£ ņØ╝ņØ╝ Ļ▓āņØ┤ļŗż.